사노피ㆍ얀센, 랩스커버리 약물 후속 임상시험 진입ㆍ스펙트럼도 '롤론티스' 막바지 임상 순항..'포지오티닙' 등 기술수출 신약 후속 임상진입ㆍ적응증 확대 시도

일찌감치 기술수출한 랩스커버리 약물 '롤론티스'의 막바지 임상시험이 순항 중이고 항암제 '포지오티닙'의 새로운 가능성이 발견되는 등 기존 기술수출 신약의 가능성이 높아지고 있다. 올해 단 한 건의 권리 반환이나 임상 중단 악재가 발생하지 않았다는 점이 긍정적인 소식이다.
◇사노피ㆍ얀센, 랩스커버리 약물 후속임상 착수..스펙트럼, '롤론티스' 임상3상 순항
29일 국제 임상시험 등록사이트 클리니컬트라이얼즈(Clinical Trials)에 따르면 사노피는 오는 12월 4일부터 에페글레나타이드의 임상3상시험의 환자 모집을 시작한다.
에페글레나타이드는 GLP-1 계열의 당뇨치료제로 한미약품 기반 기술인 ‘랩스커버리’가 적용된 약물이다. 랩스커버리는 바이오의약품의 짧은 반감기를 늘려주는 플랫폼 기술로 투여 횟수 및 투여량을 감소시켜 부작용은 줄이고 효능은 개선하는 기술이다. 약물의 체내 지속성을 증대시키기 위해 부착하는 단백질 ‘랩스캐리어’를 바이오 의약품에 화학적으로 결합하면 적은 용량으로도 약효를 최대 1개월까지 유지시키는 방식이다.
에페글레나타이드의 임상시험에서는 400명의 제2형 당뇨환자를 대상으로 에페글레나타이드를 주 1회 투여한 이후 30주 집중치료와 26주간 확장치료를 통해 안전성과 유효성을 검증한다.

사노피는 그동안 분기 실적 발표와 함께 연구개발(R&D) 파이프라인을 공고하면서 에페글레나타이드의 4분기 임상 착수를 천명했고 이번에 공식 임상 개시를 알렸다. 다만 에페글레나타이드의 경우 지난해 말 계약 내용 수정 이후 한미약품이 연구비의 25%를 부담키로 하는 조항을 반영하면서 향후 비용 지출은 늘어날 전망이다.
에페글레나타이드의 임상3상 시작으로 지난해 임상시험이 지연된 랩스커버리 적용 약물이 모두 상업화를 위한 개발이 재개됐다.
랩스커버리 기술이 적용된 당뇨비만치료제 ‘JNJ-64565111’(한미 과제명 HM12525A)은 지난해 말 임상1상시험을 진행하다 임상용 의약품 공급이 차질이 생기면서 임상이 중단됐지만 지난 6월 새로운 임상시험이 재개됐다.
한미약품 입장에선 랩스커버리 약물의 임상 재개는 반가운 소식이다. 한미약품은 지난 2015년부터 본격적으로 글로벌 기업들고 맺운 기술수출 계약 중 랩스커버리 약물이 차지하는 비중이 가장 컸지만 후속 개발 과정은 순탄치 않았다.
한미약품은 2015년 11월 사노피와 퀀텀프로젝트(에페글레나타이드, 지속형인슐린, 지속형인슐린콤보)의 기술이전 계약을 맺었다. 계약금 4억유로(약 4800억원)를 포함해 총 39억 유로(약 4조9000억원)에 달하는 국내 제약산업 역사상 최대 규모에 달하는 기술이전 계약이다.
당초 에페글레나타이드는 지난해 하반기 임상3상시험 착수 예정이었지만 생산 지연으로 임상 일정이 미뤄졌다. 사노피는 지난해 말 지속형인슐린의 권리를 반환했고, 지속형인슐린콤보는 일정기간 한미약품의 책임으로 개발한 이후 사노피가 이를 인수하는 ‘조건부 기술이전’으로 계약 내용이 변경됐다. 계약 내용 변경으로 마일스톤 규모도 축소됐지만 2개 제품이 모두 상업화에 성공하면 총 28억2400만 유로(약 3조4000억원)를 받는 조건으로 여전히 역대 신기록에 해당하는 규모다.
얀센에 기술수출한 ‘HM12525A’는 계약금 1억500만달러(약 1150억원) 포함해 전체 계약 규모는 9억1500만달러(약 1조원)로 역대 2위 규모의 계약이다.
얀센에 이어 사노피가 랩스커버리 약물의 임상시험을 다시 시작한 것은 생산 지연 이슈가 소멸됐음을 의미한다. 한미약품 측은 “랩스커버리 적용 의약품의 생산 지연 문제로 일정에 다소 차질이 발생했지만 모두 해결되면서 후속 임상시험이 재개됐다”라고 설명했다.
한미약품이 일찌감치 기술 수출한 또 다른 랩스커버리 약물 ‘롤론티스’도 개발에 속도를 내면서 상업화 단계에 근접했다. 지난 2012년 미국 제약사 스펙트럼 파마슈티컬에 기술수출된 ‘롤론티스’는 기존 호중구감소증치료제의 약효 지속 시간을 늘린 약물이다. 호중구감소증이란 우리 몸 면역체계에서 감염을 물리치는 혈액내 세포인 백혈구 중 호중구라는 특정세포가 비정상적으로 줄어들어 면역력이 현저하게 떨어지는 상태를 말한다.
한미약품은 롤론티스의 임상1상시험을 마치고 기술이전했고 스펙트럼은 2015년 말부터 임상3상시험을 진행 중이다. 스펙트럼은 2018년 1분기에 롤론티스의 1차 임상3상 결과를 발표하고 내년 중 허가 신청을 제출할 계획이다.

◇'포지오티닙' 적응증 확대 임상 돌입..릴리 등도 후속 임상시험 진행 중
지난 몇 년간 한미약품이 기술 수출한 굵직한 제품 중 권리 반환된 ‘올무티닙’(베링거인겔하임)과 지속형인슐린(사노피)을 제외하면 모두 후속 임상시험이 순조롭게 진행 중이다.
스펙트럼에 기술수출한 항암신약 ‘포지오티닙’은 개발 과정에서 탁월한 효과가 발견되면서 개발에 박차를 가하고 있다. 포지오티닙은 한미약품이 지난 2015년 스펙트럼에 기술수출한 pan-HER2 항암제다. 스펙트럼은 포지오티닙의 연구 과정에서 유전자 엑손(exon) 20에 변이가 생긴 비소세포폐암 종양모델에 획기적인 효과가 있을 것이란 잠재력을 발견하고 폐암치료제 개발을 위한 임상시험을 진행 중이다.
엑손은 유전자의 염기 배열 중 단백질 합성 정보를 가진 부분으로 EGFR 변이 비소세포폐암 환자의 10% 가량에서 20번째 엑손 유전자가 변이되는 것으로 알려졌지만 현재까지 이를 표적해 치료하는 의약품은 없다.
지난달 스펙트럼이 세계폐암학회(WCLC)에서 미국 임상2상 중간결과를 발표했는데 환자 11명 중 8명인 73%에서 포지오티닙의 객관적 반응률(ORR) 및 부분 반응률(PR)을 보였다. 당시 임상시험을 진행한 엠디앰더슨 암센터의 존 헤이마크 교수는 “포지오티닙 임상결과는 놀라웠다(These data are remarkable)”라고 호평했다.
최근 스펙트럼은 포지오티닙의 임상 대상을 비소세포폐암 'EGFR exon 20' 돌연변이에서 'HER2 exon 20' 돌연변이까지 확대하는 임상2상시험에 착수했다. 한미약품은 대규모 임상에서도 지금까지와 동등한 항암효과만 입증된다면, 비소세포폐암 환자군를 대상으로 한 약물 허가가 앞당겨질 것으로 기대하는 분위기다.
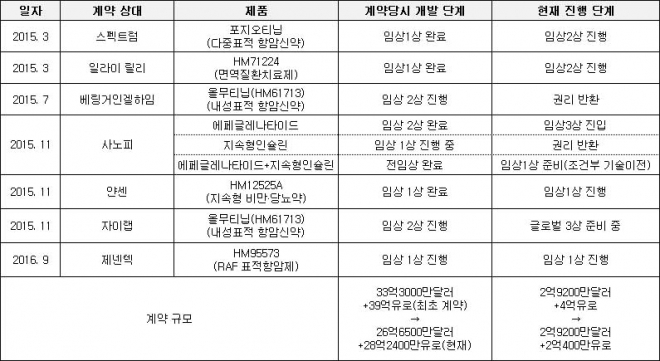
2015년 9월 일라이릴리에 기술 수출된 자가면역질환 치료제 ‘HM71224'(릴리 과제명 LY3337641)는 지난해 9월 글로벌 임상2상시험 단계에 진입했다. 이 임상시험에서는 류마티스관절염 환자를 대상으로 안전성과 유효성을 평가한다.
국내에서는 판권을 보유한 한미약품 주도로 후속 임상시험에 속도를 내고 있다. 한미약품이 지난해 9월 제넨텍에 기술수출한 RAF 표적항암제 ‘HM95573'의 경우 올해 들어 2건의 새로운 임상시험에 돌입했다. 한미약품은 지난 2월 BRAF, KRAS 또는 NRAS 유전자 변이 고형암 환자에서 HM95573 단독치료의 유효성 탐색 및 안전성 평가를 위한 임상1상시험을 시작했다. 지난달에는 국소 진행성 또는 전이성 고형암 환자를 대상으로 ’코비메티닙‘과 HM95573의 안전성, 내약성, 약동학을 평가하는 임상1상시험 계획을 승인받았다.
지난해 5월 임상2상시험을 마치고 식품의약품안전처처로부터 조건부승인을 받은 ‘올리타’는 지난 4월 임상3상시험 계획을 승인받았다.
한미약품이 기술수출한 신약이 글로벌 무대에서 다음 개발 단계에 진입하는 것은 한미약품의 기술수출 수익의 증가를 의미한다. 한미약품은 2015년부터 올해 3분기까지 총 5887억원의 기술료 수익을 거뒀다.











!["여기도 품절이라고요?"…Z세대 '뷰티 방앗간' 된 다이소, 다음 대란템은? [솔드아웃]](https://img.etoday.co.kr/crop/320/200/2105870.jpg)