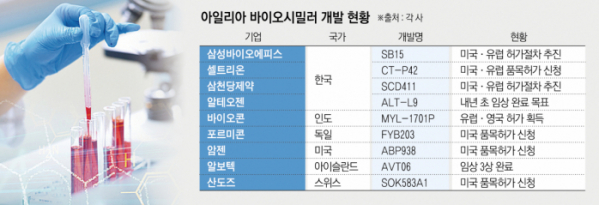
삼성바이오에피스·셀트리온·삼천당제약·알테오젠, 글로벌 시장 공략 나서
연매출 12조 원을 넘는 블록버스터 안과질환 치료제 ‘아일리아’(성분명 애플리버셉트)의 바이오시밀러 경쟁이 개막을 앞두고 있다. 국내에서만 4개 제약·바이오기업이 개발하면서 주 무대인 미국과 유럽에서 각축전을 벌일 것으로 예상된다.
27일 본지 취재를 종합하면 아일리아 바이오시밀러의 개발을 완료하고 글로벌 허가에 나선 국내 기업은 삼성바이오에피스와 셀트리온, 삼천당제약이다. 알테오젠의 경우 내년 초까지 임상 3상을 마칠 계획이다.
삼성바이오에피스는 ‘SB15’의 임상 3상을 지난해 3월 완료하고, 미국과 유럽 등 주요국에서 허가 절차를 추진하고 있다. 경쟁사에 대한 전략 노출을 우려해 정확한 허가 신청 시기 등은 공개하지 않는단 방침이다.
SB15는 삼성바이오에피스의 두 번째 안과질환 치료제다. 올해 4월 공개된 임상 3상 최종 데이터에 따르면 미국과 한국 등 10개국에서 습성 연령 유관 황반변성 환자 449명을 대상으로 진행한 결과 오리지널 의약품 대비 동등성과 안전성, 면역원성 등을 확인했다.
삼성바이오에피스 관계자는 “일찌감치 바이오젠과 파트너십을 맺고 주요국 마케팅을 준비하고 있다”라면서 “이미 ‘루센티스’ 바이오시밀러를 판매 중인만큼 안과질환 관련 노하우와 경쟁력을 발휘할 수 있을 것”이라고 말했다.
올해 ‘CT-P42’의 임상 3상을 마친 셀트리온은 6월 미국, 이달 유럽에서 품목허가를 신청했다. 이에 따라 자가면역질환과 항암제에 이어 안과질환으로 제품 포트폴리오를 확장하게 됐다. 임상 3상은 체코와 헝가리, 폴란드, 스페인 등 총 13개국에서 당뇨병성 황반부종 환자 348명을 대상으로 진행됐다.
삼천당제약도 미국과 유럽에서 ‘SCD411’의 허가 절차를 추진 중이다. 허가는 유럽에서 먼저 이뤄질 전망이다. 회사는 글로벌 파트너사들과 협력해 허가 및 출시를 진행할 계획이다.
이달 20일에는 유럽 5개국(독일, 스페인, 이탈리아, 스위스, 오스트리아)에 독점 판매·공급하는 280억 원 규모의 계약을 맺었다고 공시했다. 계약에 따라 이익의 50%를 분기별로 정산받으며, 영국과 프랑스 등 다른 국가와도 계약을 진행할 예정이다. 앞서 8월에는 캐나다와 200억 원 규모의 계약을 체결했다.
미국 리제네론이 개발한 아일리아는 지난해 기준 97억5699만 달러(약 12조6841억 원)의 글로벌 매출을 올렸을 만큼 시장성이 뛰어나다. 국내 기업 외에도 바이오콘, 포르미콘, 암젠, 알보텍, 산도즈가 개발에 나서 임상 3상을 완료했다. 미국 독점권은 내년 5월, 유럽 물질특허는 2025년 11월 만료된다.
그러나 글로벌 무대에는 이미 아일리아의 강력한 라이벌이 등장했다. 바로 로슈가 개발해 지난해 2월 미국 식품의약국(FDA) 승인을 받은 ‘바비스모’(성분명 파리시맙)다.
바비스모는 기존 치료제가 표적하는 혈관내피성장인자-A(VEGF-A)에 더해 망막 혈관의 안정성을 저하하는 안지오포이에틴-2(Ang-2)을 함께 억제한다. 특히 16주에 한 번으로 투약 주기를 대폭 늘려 환자 편의성을 끌어올렸다.
이런 강점을 무기로 바비스모는 단숨에 글로벌 블록버스터 약물에 등극했다. 로슈의 실적 발표 자료에 따르면 바비스모의 매출은 분기마다 급성장해, 로슈는 올해 3분기까지 약 17억 달러(약 2조2000억 원)를 달성했다.
반면 아일리아의 매출은 점차 하향곡선을 그리고 있다. 이에 따라 리제네론은 고용량 제품(아일리아HD)의 출시로 반등에 나섰다.
아일리아HD는 용량을 8㎎으로 늘린 제품이다. 처음 3개월 동안 4주 간격으로 투약한 후, 최대 12~16주 간격까지 투약 주기를 확대할 수 있다. 리제네론은 바이오시밀러가 시장에 진입하기 전에 환자들을 아일리아HD로 전환, 아성을 유지하겠단 전략이다.











![2026년 휴일 달력…내년 빅 이벤트는? [해시태그]](https://img.etoday.co.kr/crop/320/200/2273686.jpg)