식품의약품안전처가 코로나19 진단시약과 같은 체외진단의료기기의 안전관리를 위해 제정한 ‘체외진단의료기기법’이 1일부터 시행된다.
식약처는 질병의 치료에서 진단 등 예방 중심으로 패러다임이 변화하고, 인체에 직접 사용하는 일반 의료기기와 달리 혈액‧소변 등 검체를 대상으로 하는 체외진단의료기기 특성을 반영해 지난해 4월 30일 ‘의료기기법’에서 분리해 체외진단의료기기법을 제정했다.
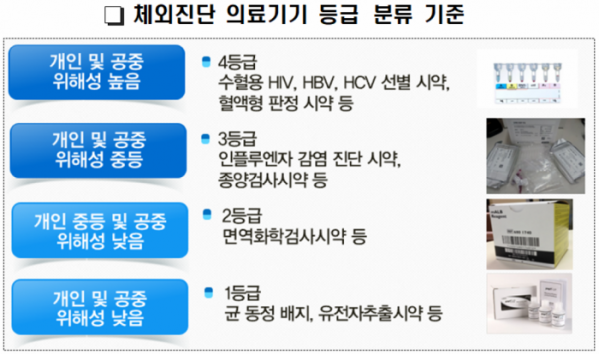
이에 따라 체외진단의료기기 등급은 안전관리 수준이 높은 순서에 따라 4등급부터 1등급까지 4개 등급으로 분류한다.
체외진단의료기기의 허가‧심사는 △3~4등급 허가 △2등급 인증 △1등급 신고로 구분해서 관리한다. 허가‧인증은 제품성능을 확인할 수 있도록 분석적 성능시험 및 임상적 성능시험을 구체화한다.
변경허가는 간소화한다. 안전성·유효성에 영향을 미치지 않는 경미한 변경사항은 사후 보고하도록 해 신속한 제품 출시를 지원한다.
식약처는 임상적 성능시험 기반도 확대한다. 우선, 임상적 성능시험 기관은 의료기관, 혈액원, 의과대학 및 검체수탁·분석기관 등에서 지정한다. 임상적 성능시험을 위해서는 사전에 심사위원회 승인을 받아야 하며, 임상적 성능시험 종사자는 전문교육을 매년 8시간 이상 이수해야 한다.
또한, 의료기관 및 유전자검사기관에 대해서는 차세대염기서열분석 체외진단검사 인증제를 실시하기로 했다.
식약처 관계자는 “체외진단의료기기 특성에 맞는 안전관리체계를 마련하고 국제기준에 맞는 제도를 운영함으로써 체외진단의료기기 산업 육성 및 새로운 치료기회 확대를 기대할 수 있을 것”이라고 말했다.











![[찐코노미] 공포에 질린 증시, 트럼프가 숨긴 진짜 계획은?](https://img.etoday.co.kr/crop/320/200/2147569.jpg)