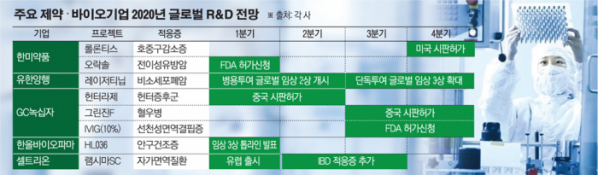
국내 제약·바이오기업들이 새해에도 신약 연구·개발(R&D)에 박차를 가한다. 세계 최대 시장 미국은 물론 유럽과 중국 등 글로벌 시장에서 시판허가를 비롯한 ‘K-바이오’의 성과를 보여줄 전망이다.
18일 업계에 따르면 내년에는 한미약품과 유한양행, 셀트리온 등 굵직한 기업을 중심으로 활발한 글로벌 R&D가 펼쳐진다.
한미약품은 4분기 장기지속형 호중구감소증 치료제 ‘롤론티스’의 미국 시판허가를 기대하고 있다. 롤론티스는 한미약품이 개발해 2012년 미국 스펙트럼에 기술수출한 바이오 신약이다.
스펙트럼은 올해 10월 2건의 임상 3상 데이터를 토대로 미국 식품의약국(FDA)에 롤론티스의 바이오의약품 시판허가(BLA)를 신청했다. 전 세계 호중구감소증 치료제 시장 규모는 2016년 기준 77억 달러(8조9700억 원)에 달하며, 연평균 5.6%씩 성장해 2025년에는 125억 달러(14조5700억 원)까지 확대할 것으로 전망된다.
주사용 항암제를 경구용으로 전환하는 한미약품의 플랫폼기술 ‘오라스커버리’가 적용된 항암신약 ‘오락솔’은 내년 1분기 FDA 신약허가신청(NDA)이 가능할 것으로 예상된다. 파트너사 아테넥스는 오락솔의 임상 3상 시험에서 전이성 유방암 환자를 대상으로 파클리탁셀 정맥주사 제형 대비 1차 유효성 평가 지표인 객관적 반응률(ORR)의 유의성을 확인했다.
유한양행은 비소세포폐암 치료제 ‘레이저티닙’의 글로벌 임상 개발에 속도를 낸다. 레이저티닙을 기술도입한 얀센은 이중항체 병용투여 임상 2상을 상반기 중 개시할 예정이다. 동물실험에서는 기존 치료제인 아스트라제네카의 ‘타그리소’에 내성이 발생하는 간세포성장인자수용체(c-Met) 과발현 암 세포종에서 뛰어난 종양 크기 감소 효과를 확인했다. 개발에 성공하면 혁신신약으로 높은 가치를 평가받게 된다.
레이저티닙 단독투여는 최근 식품의약품안전처의 승인을 받아 한국을 시작으로 글로벌 임상 3상에 진입한다. 2차 치료제에서 1차 치료제로 적응증이 확대하면서 매출액이 폭발적으로 성장한 타그리소를 정조준하는 전략이다. 타그리소 시장은 2024년 58억 달러(6조7700억 원)까지 불어날 것으로 예상되는데, 레이저티닙의 단독투여 임상이 성공하면 이를 나눠 가질 수 있다.
특히 레이저티닙은 국내 임상 2상 결과를 토대로 연초 조건부 허가에 도전한다. 차질없이 진행되면 2020년 내 조건부 허가가 가능할 것으로 보인다.
GC녹십자는 중국 시장을 공략한다. 희소질환 치료제 ‘헌터라제’와 ‘그린진에프’가 각각 상반기와 하반기 시판허가를 앞두고 있다.
헌터라제는 GC녹십자가 2012년 세계 두 번째로 개발한 헌터증후군 치료제다. 중국에서는 샤이어의 ‘엘라프라제’보다 먼저 시판허가를 받을 것으로 기대된다. 헌터증후군은 IDS(Iduronate-2-sulfatase) 효소 결핍으로 골격 이상, 지능 저하 등이 발생하는 선천성 희소질환이다.
그린진에프는 3세대 유전자재조합 방식의 A형 혈우병 치료제다. GC녹십자는 2016년 그린진에프의 미국 임상 3상을 중단하고 성장 잠재력이 큰 중국 시장 진출에 주력했다.
혈액제제 아이글로불린(IVIG)은 10% 제품으로 하반기 미국 허가에 재도전한다. 미국 IVIG 시장에서 10% 제품은 시장의 70%가 넘는 4조 원대 규모를 형성하고 있다.
셀트리온은 세계 최초 인플릭시맙 피하주사 제제 ‘램시마SC’를 유럽 시장에 본격적으로 출시한다. 램시마SC는 셀트리온의 바이오시밀러 ‘램시마’를 정맥주사(IV)에서 피하주사(SC)로 바꿔 편의성을 높인 바이오베터다. 유럽의약품청(EMA)은 지난달 류머티즘 관절염(RA) 적응증에 대해 판매를 허가했다.
회사 관계자는 “내년 2월부터 램시마SC를 유럽 각 국가에 차례로 선보일 것”이라고 설명했다. 램시마SC는 수익성을 극대화하기 위해 14개의 법인 및 지점을 잇는 자체 직판망을 통해 판매된다.
이와 함께 셀트리온은 내년 중반을 목표로 염증성장질환(IBD)을 포함한 자가면역질환 전체에 대한 승인을 추진한다. 적응증을 추가하면 약 10조 원 규모의 유럽 TNF-α 억제제 시장을 공략할 수 있다.
이달 중 안구건조증 치료제 ‘HL036’의 임상 3상 톱라인 데이터를 발표할 예정이던 한올바이오파마는 데이터 검증을 위해 시기를 1월로 늦췄다. HL036은 대웅제약과 공동 개발하는 바이오 신약이다.
안구건조증 시장은 2017년 기준 전 세계 4조 원 규모다. 연평균 7%씩 시장 규모가 성장해 2027년 7조 원으로 확대될 것으로 전망되지만, 효과가 뛰어난 치료제가 아직 없다. 그럼에도 노바티스는 다케다의 ‘자이드라’를 53억 달러(6조1800억 원)에 사들였다. 업계는 HL036이 임상 3상에서 충분한 효과와 안전성을 증명하면 더욱 높은 가치로 기술수출 가능성이 부각할 것이라 보고 있다.





