홍승서 신임 CEO, WSJ와 인터뷰서 올 3분기 전망

류머티즘 관절염 치료제이자 세계 최초 항체 바이오시밀러인 ‘램시마’로 유명한 셀트리온이 유럽에 이어 미국시장 진출을 모색하고 있다.
셀트리온의 배급·마케팅 사업부인 셀트리온헬스케어의 홍승서 신임 최고경영자(CEO)는 1일(현지시간)자 미국 월스트리트저널(WSJ)과의 인터뷰에서 “미국 식품의약국(FDA)으로부터 램시마 승인을 기다리고 있다”며 “승인이 떨어지면 올 하반기에 약품 출하를 시작해 내년이면 판매에 들어갈 수 있을 것”이라고 밝혔다. 홍 CEO는 지난달 말 주주총회에서 셀트리온헬스케어 대표에 올랐다.
셀트리온은 이미 램시마를 유럽 시장에서 판매하고 있으며 지난해 FDA에 승인을 신청했다. 최근 FDA자문위원회는 이 약품에 대한 추가 자료를 요구하며 일정을 연기했다.
그러나 홍 CEO는 “이는 정상적인 절차”라며 “우리는 늦어도 올 3분기에는 승인을 받을 것으로 보고 있다. 우리 제품의 품질은 오리지널과 같으며 모든 규제 조건을 충족하고 있다”고 자신했다. 이어 “승인을 받으면 셀트리온의 미국 판매 파트너인 호스피라를 통해 내년부터 ‘인플렉트라(Inflectra)’라는 이름으로 판매될 것”이라고 설명했다.
또 홍 CEO는 “셀트리온의 헬스케어 부문을 한국이나 해외에서 기업공개(IPO)하는 방안도 고려하고 있다”며 “이는 자금조달과 주주가치를 높이려는 의도”라고 밝혔다.
이와 관련해 회사 관계자는 “현재 IPO를 위한 주간사 은행을 고르는 작업 중”이라고 덧붙였으나 IPO 규모와 시점 등 세부사항 언급은 피했다.
셀트리온은 지난 2002년 설립됐으며 2007년부터 본격적으로 바이오시밀러를 개발하기 시작했다. 홍승서 CEO는 “당시 우리는 일부 메이저 바이오의약품 특허가 2010년에 만료된다는 점을 알았다”며 “이에 바이오시밀러를 제 때 공급하고자 개발에 착수했다”고 말했다.
램시마는 지난 2013년 9월 유럽의약품감독국(European Medicines Agency, EMA)의 승인을 받아 캐나다와 일본 등 전 세계 26개국에서 팔리고 있다.
셀트리온은 또 유방암과 비호지킨스림프종 치료에 쓰이는 바이오시밀러 2종을 개발하고 있으며 이들 약품은 연말 EMA에 승인 신청서를 낼 계획이다.
바이오시밀러는 일반 합성의약품 복제약인 제너릭과 비슷한 개념이다. 그러나 생물체에서 나온 성분으로 만든 바이오의약품 복제약이기 때문에 오리지널과 100% 화학적 조정이 같지는 않아 비슷하다는 의미의 ‘시밀러’라는 명칭을 붙이고 있다.
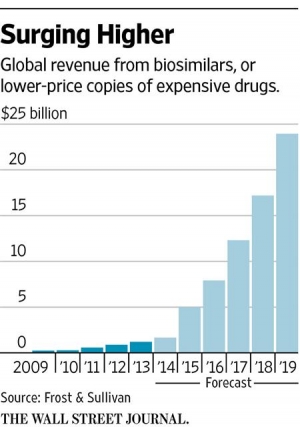
바이오의약품 특허가 계속 만료되는 상황이기 때문에 이보다 저렴한 바이오시밀러시장이 급성장하고 있다. 유럽에서는 이미 수년 전부터 바이오시밀러 판매가 들어갔으나 미국은 안전에 대한 우려와 제약업체들의 반발로 진입할 수 없었다. 그러나 지난달 FDA는 바이어시밀러 분야 최초로 노바티스 자회사인 산도즈의 ‘작시오(Zarxio)’를 승인하면서 빗장을 풀었다. 이에 세계 최대 의약품시장인 미국에서 바이오시밀러에 대한 기대가 커지고 있다.
한국생명공학연구원 조사에 따르면 글로벌 바이오시밀러 시장규모는 지난 2012년의 8억8000만 달러에서 오는 2019년 240억 달러(약 26조5200억원)로 팽창할 전망이다. 성장률은 연평균 60.4%에 이를 것으로 예상된다.
홍승서 CEO는 “우리는 올해 매출을 2~3배로 확대시킬 계획”이라며 “이는 어려운 목표가 아니다”라고 강조했다.





