10월부터 유럽·중남미 판매 시작
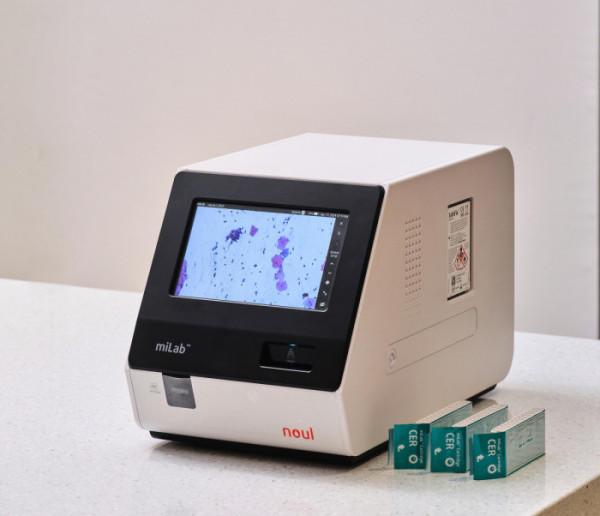
인공지능(AI) 기반 혈액 및 암 진단 전문기업 노을 주식회사는 자궁경부암 진단 솔루션 마이랩(miLab™) CER의 주요 구성품인 자궁경부암 진단 카트리지(miLab™ Cartridge CER)와 세척 용액(SafeFix™ CER)에 대한 미국 식품의약국(FDA) 의료기기 제품 등록(Device Listing)을 완료했다고 22일 밝혔다.
이번 등록으로 노을은 미국 시장 판매 및 유통을 위한 최소 요건을 충족했다. 10월부터 유럽과 중남미 기허가 국가를 중심으로 마이랩 CER의 판매가 본격화될 예정이다.
노을은 기존 마이랩 플랫폼, 말라리아 진단 및 혈액 분석 카트리지에 더해 이번 자궁경부암 진단 카트리지의 미국 FDA 등록으로 미국 시장의 진입 기반을 마련했다. 현재 등록된 마이랩 플랫폼에 추가될 각 질환별 분석 소프트웨어에 대한 단계별 FDA 시판 전 허가(510k)를 준비 중이다.
임찬양 노을 대표는 “이번 등록은 미국 진출을 위한 중요한 절차이자 글로벌 시장 확장의 모멘텀을 강화하는 계기”라며 “특히 유럽과 중남미 출시에 맞춰 카타르, 파나마, 영국 등 이미 허가를 획득한 국가들을 중심으로 miLab CER의 출고가 본격화될 것”이라고 말했다.
미국에서 자궁경부암은 조기 발견 시 5년 생존율이 90% 이상이지만 말기 진단 시 생존율은 20% 미만 수준이다. 보험 미가입자·저소득층 여성의 자궁경부암 스크리닝 수검률이 평균보다 20% 이상 낮고, 아프리카계 미국 여성의 발병률이 백인 여성 대비 60% 높으면서 사망률은 2배 이상에 달해 인종·소득·지역에 따른 격차가 뚜렷하다.
마잉랩 CER은 자궁경부 세포병리검사를 자동화하는 AI 기반 진단 솔루션으로 샘플 전처리부터 이미징, AI 분석까지 통합 수행한다. 2024년 세계보건기구(WHO)의 국제의약품구매기구(UNITAID) 보고서에서 로슈, 홀로직과 함께 글로벌 3대 제품으로 권고됐다.









![[케팝참참] 현역가왕3, 아이돌·국악·전통 트롯까지…실력파 경쟁 본격화](https://img.etoday.co.kr/crop/320/200/2283644.jpg)