유한양행 ‘레이저티닙’ 글로벌 임상 속도전ㆍ한미약품 ‘오락솔’ 1분기 내 美서 NDAㆍ셀트리온 '램시마SC' 유럽서 허가
미국 샌프란시스코에서 열린 세계 최대 헬스케어 투자행사 ‘JP모건 헬스케어 콘퍼런스’에서 각국의 눈이 ‘K-바이오’를 주시했다. 국내 대표 바이오기업 삼성바이오로직스와 셀트리온은 15일(현지시간) 나란히 이번 콘퍼런스의 메인 행사장인 그랜드볼룸에 섰다. 콘퍼런스에 참석한 전 세계 500여 기업 중 그랜드 볼룸에서 발표할 기회를 얻은 곳은 37개다. 그 중 아시아 기업은 삼성바이오로직스와 셀트리온, 일본의 다케다까지 단 3곳뿐이었다.
‘K바이오’가 글로벌 시장에서 날개를 펴고 있다. 끊임없는 도전으로 제약 선진국 미국과 유럽에서 존재감을 드러내고 있는 것이다.
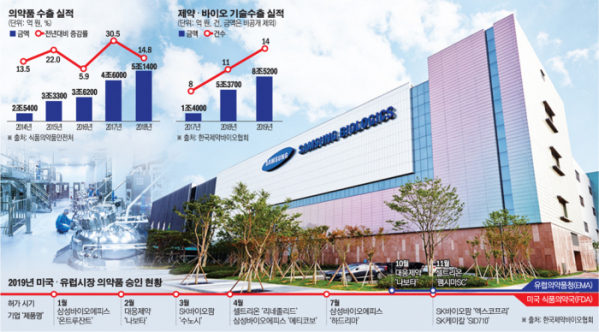
달라진 K바이오의 위상은 선진 시장 허가 실적과 수출 실적이 증명한다. 28일 업계에 따르면 지난해 미국 식품의약국(FDA) 허가를 받은 국산 의약품은 대웅제약의 ‘나보타’, SK바이오팜의 ‘엑스코프리’ 등 총 8건으로 역대 최대 규모를 기록했다. 유럽의약품청(EMA)에서도 셀트리온의 ‘램시마SC’를 포함한 2건의 허가를 획득했다.
의약품 수출실적도 매년 역대 최대 기록을 경신하고 있다. 2018년 의약품 수출액은 46억7300만 달러(5조1400억 원)로 전년 대비 14.8% 늘었다. 2014년(2조5400억 원)과 비교하면 2배 이상 증가한 규모다.
특히 K바이오는 잇따른 기술수출로 신약 연구·개발(R&D) 능력을 증명했다. 유한양행의 비알코올성지방간염 치료제를 비롯해 브릿지바이오, 알테오젠까지 2019년 1년 동안 14건의 기술수출에 성공했다. 이는 계약 규모를 공개하지 않은 사례를 제외해도 총 8조5200억 원에 이른다. 업계 관계자는 “한국 제약·바이오산업의 성장 가능성과 잠재력은 세계 시장에서 상당 부분 인정받고 있다”면서 “국가의 미래가 달린 유망산업으로 확실히 자리매김했다”고 말했다.
올해 K바이오는 탄탄한 업력의 업계 상위 제약사들과 기술력을 갖춘 바이오기업이 함께 이끌어나갈 전망이다.
매출액 기준 업계 1위 유한양행은 비소세포폐암 치료제 ‘레이저티닙’의 글로벌 임상 개발에 속도를 낸다. 레이저티닙을 기술도입한 얀센은 이중항체 병용투여 임상 2상을 상반기 중 개시할 예정이다. 레이저티닙 단독 투여는 한국을 시작으로 글로벌 임상 3상에 진입한다. 성공 시 2024년 58억 달러(6조7700억 원)까지 불어날 1차 치료제 ‘타그리소’ 시장을 나눠 가질 수 있다.
한미약품의 장기지속형 호중구감소증 치료제 ‘롤론티스’는 4분기 미국 시판허가를 획득할 것으로 기대된다. 롤론티스는 한미약품이 개발해 2012년 미국 스펙트럼에 기술수출한 바이오 신약이다. 플랫폼기술 ‘오라스커버리’가 적용된 항암신약 ‘오락솔’은 1분기 내 FDA 신약허가신청(NDA)이 가능할 것으로 보인다.
GC녹십자는 혈액제제 아이글로불린(IVIG) 10% 제품으로 하반기 미국 허가에 재도전한다. 미국 IVIG 시장에서 10% 제품은 시장의 70%가 넘는 4조 원대 규모를 형성하고 있다.
셀트리온은 지난해 11월 EMA 허가를 획득한 램시마SC를 유럽 시장에 본격적으로 출시한다. 램시마SC는 셀트리온의 바이오시밀러 ‘램시마’를 정맥주사(IV)에서 피하주사(SC)로 바꾼 세계 최초 인플릭시맙 SC제제다. 이와 함께 램시마SC의 적응증을 염증성장질환(IBD)을 포함한 자가면역질환 전체로 확대할 방침이다. 적응증을 추가하면 약 10조 원 규모의 유럽 TNF-α 억제제 시장을 공략할 수 있다.
지난해 다소 미진한 임상 3상 결과를 냈던 바이오기업들도 미국 시장 진출에 박차를 가한다. 메지온은 선천적 단심실증 환자의 폰탄수술 합병증 치료제 ‘유데나필’의 NDA를 1분기에 제출할 계획이다. FDA 희귀의약품으로 지정된 유데나필은 일정대로 NDA를 내면 신속심사를 거쳐 연내 허가 여부가 판가름난다.
경구용 항암제 ‘리보세라닙’을 개발 중인 에이치엘비는 미국 자회사 엘레바를 통해 상반기 중 NDA를 신청한다. 현지 마케팅 전문가를 영입하는 등 허가 후 시판을 위한 준비도 병행하고 있다.
헬릭스미스는 당뇨병성 신경병증 치료제 ‘엔젠시스’의 후속 임상 3상에 돌입한다. 내년까지 임상을 완료하고 하반기 FDA에 바이오의약품 시판허가(BLA)를 제출하는 것이 목표다. 이에 앞서 다음 달 생명과학 분야의 손꼽히는 학회인 미국 키스톤 심포지엄에 참석해 엔젠시스의 재생의약 가능성 등을 발표할 예정이다.









![[컬처콕] 보이넥스트도어, 라이즈와 닮은 듯 다른 점](https://img.etoday.co.kr/crop/320/200/2014561.jpg)