품질관리기준 강화돼 의약품수출에도 도움
새 GMP제도가 도입된 뒤 제약산업의 산업경쟁력 강화에 큰 기여를 한 것으로 나타났다.
식품의약품안전청은 2008년부터 새 GMP제도를 도입해 2년간 시행한 결과, 국내 제약업계가 '소품목 대량생산'의 선진국형으로 재편되고 있으며 품질이 우수한 의약품의 생산기반 마련으로 국내 제약사들의 미국과 EU등 대외 신인도가 제고돼 산업경쟁력 강화에 큰 기여를 한 것으로 나타났다고 27일 밝혔다.
GMP(Good Manufacturing Practice, 의약품 제조 및 품질관리기준)이란 우수한 의약품을 제조하기 위해 공장에서 원료의 구입부터 제조·출하 등에 이르는 모든 과정에 필요한 관리기준을 규정한 것을 말한다.
식약청은 2008년 새 GMP제도 시행 후, 그 간의 시행성과를 종합 분석해 보면 크게 품목 구조조정을 통한 제약산업 재편과 우수한 품질의 의약품 공급기반 마련으로 대외경쟁력 제고를 들었다.
새 GMP 제도 시행 이전 전문의약품의 허가신청 건수가 월평균 약 150건이었으나, 제도 시행 이후 월평균 약 30건 정도로 80%나 감소하는 등 '다품목 소량생산'의 후진국형 제약산업 구조가 '소품목 대량생산'의 선진국 형으로 발전하고 있다.
새 GMP 제도 시행 전후 유통 의약품 수거검사결과를 살펴보면, 부적합 건수가 2006년 86건에서 시행 후 20여건으로 줄어드는 등 품질 부적합율이 뚜렷한 감소를 보여 품질 향상에도 기여한 것으로 나타났다.
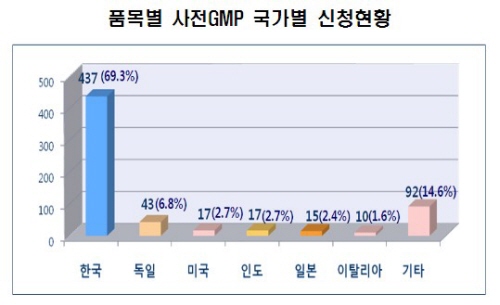
특히 새 GMP 평가 도입 이전에는 국내 제약업체는 주로 원료의약품에 국한해 미국·EU 등 외국으로부터 GMP 실사를 받았으나, 새 GMP제도 이후에는 완제의약품 업체도 외국 실사를 받는 사례가 증가하고 있다.
식약청은 사전실사제도를 시행하는 등 국내 제약업체의 원활한 수출 지원시스템을 마련하고 선진국 GMP관련 정보교환을 활성화하는 등 국내의약품의 세계시장 진출을 위한 교두보를 마련, 제약산업 경쟁력 제고를 위해 노력하겠다고 밝혔다.











![키키도 소환한 그 감성⋯Y2K, 왜 아직도 먹히냐면요 [솔드아웃]](https://img.etoday.co.kr/crop/320/200/2292619.jpg)