바이엘 고용량 ‘아일리아HD’ 美·유럽 허가…노하우·신뢰도 전략 마련

황반변성 치료제 ‘아일리아(성분명 애플리버셉트)’의 고용량 제품이 등장하면서 국내 기업들이 출시 준비 중인 저용량 제품의 경쟁력을 확보하기 불리해졌다. 이에 따라 국내 기업들은 가격과 품질로 승부를 보겠단 전략이다.
10일 제약·바이오업계에 따르면 글로벌 제약사 바이엘은 이달 8일 유럽의약품청(EMA)으로부터 고용량 ‘아일리아HD’의 허가를 획득했다. 앞서 바이엘은 지난해 10월 미국식품의약국(FDA)에서 고용량‘ 아일리아HD’ 허가를 받은 바 있다.
아일리아는 바이엘과 리제네론 파마슈티컬스가 공동 개발한 안질환 치료용 바이오의약품이다. 제약·바이오업계에 의하면 2022년 기준 글로벌 매출이 약 97억5699만 달러(12조8800억 원)에 달하는 블록버스터 제품이다. 습식 노화 관련 황반변성(wAMD), 당뇨병성 황반부종(DME) 및 당뇨병성 망막병증(DR) 등의 치료에 사용된다.
기존 아일리아는 2㎎ 주사제로, 아일리아HD는 이보다 4배 높은 8㎎ 용량이다. 기존 저용량 제품은 1~2개월마다 투약해야 하지만, 고용량 제품은 투약 간격이 3~4개월로 길어 환자 편의성이 개선됐다. 아일리아HD가 출시되면, 저용량 중심으로 형성된 시장을 재편할 것으로 예상되는 이유다.
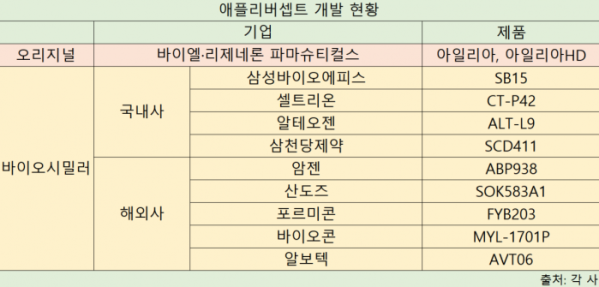
저용량 제품 출시를 준비 중인 국내 기업들은 난처한 입장이 됐다. 현재 셀트리온과 삼성바이오에피스는 아일리아의 저용량 바이오시밀러를 개발해 글로벌 3상까지 마치고 허가 심사 절차를 밟고 있다. 셑트리온은 미국, 캐나다, 유럽, 국내에 ‘CT-P42’, 삼성바이오에피스는 미국, 유럽에서 ‘SB15’에 대한 허가를 신청했다.
국내 기업들은 고용량 제품과 견주기 위한 특장점을 확보해야 하는 상황이다. 기존 자가면역치료제 시장에서도 ‘휴미라(성분명 아달리무맙)’ 100㎎ 고용량 제품이 등장해 기존 50㎎ 저용량 제품을 대체한 바 있다. 업계는 현재 미국 시장에서 휴미라 고용량 제품의 점유율은 85%로 추산한다.
아일리아 바이오시밀러 출시를 준비하는 국내외 기업 간 경쟁도 치열할 것으로 보인다. 아일리아의 미국 독점권은 2024년 5월, 유럽 물질특허는 2025년 11월에 만료될 예정이다. 국내에서는 알테오젠과 삼천당제약, 해외에서는 암젠, 산도즈, 포르미콘, 바이오콘, 알보텍 등이 아일리아 바이오시밀러를 개발 중이다.
삼성바이오에피스 관계자는 “일찍이 바이오젠과 파트너십을 맺고 안질환 치료제 바이오시밀러를 판매하고 있어, 아일리아 바이오시밀러 시장에서도 마케팅 및 영업 노하우를 발휘할 수 있을 것”이라고 내다봤다.
셀트리온 관계자는 “CT-P42의 허가 및 출시 등 예상되는 타임라인에 맞춰 사용자 편의성 측면과 신뢰도 측면에 대한 전략을 마련하고 있다”고 말했다.





