강스템바이오텍은 줄기세포 기반 융복합제제 골관절염 치료제 ‘퓨어스템-오에이 키트주’의 1/2a상을 위한 임상시험계획(IND)을 식품의약품안전처로부터 승인 받았다고 16일 밝혔다.
퓨어스템-오에이 키트주는 제대혈 유래 중간엽줄기세포와 무세포성 연골기질을 함께 투여하는 융복합제제다. 세계 최초 골관절염 근본적 치료제(DMOAD)를 목표로 하고 있다. 회사 측은 수술 없이 무릎관절강 내 주사 1회 투약만으로도 투여한 세포가 연골세포로 분화해 연골조직 재생에 직접적으로 기여함으로써 근본적인 치료 효과를 기대할 수 있다고 설명했다.
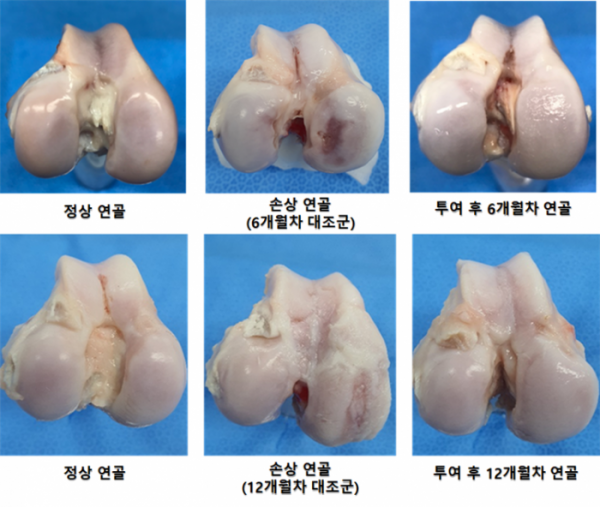
강스템바이오텍은 염소를 모델로 한 대동물시험에서 염증억제, 연골조직 및 반월판 부위 재생 등의 결과를 확보해 관절 통증완화와 함께 구조적 변형을 억제하거나 개선시킬 수 있는 치료제 개발 가능성을 시사한 바 있다. 또한, 해당시험에서 투여된 세포가 재생조직 내에 6개월까지 잔존함을 확인했다.
현재 골관절염 치료제 시장은 고령화 등으로 그 규모가 급격히 성장하고 있다. 하지만, 일시적인 통증제어 수준의 치료제 또는 신체적 부담과 부작용이 우려되는 무릎절개술, 인공관절 삽입술과 같은 치료법에 의존하고 있다.
나종천 강스템바이오텍 대표는 “이번 임상시험에 해외 파트너사들의 관심이 집중돼 있다”면서 “이미 국내를 비롯한 일본, 유럽에서 골관절염 치료제 관련 기술 특허를 취득, 향후 글로벌 사업화 및 기술이전을 위한 준비도 진행되고 있다”고 말했다. 이어 “이번 IND 승인과정에서 강화된 첨단바이오의약품의 품목허가심사 규정에 부합하고자 세포은행을 구축해 품목허가 후 공급가 또한 큰 폭으로 줄일 수 있다”고 덧붙였다.
한편, 이번 임상시험은 ICRS(International Cartilage Repair Society, 연골결손 정도에 대한 국제표준기준) 3~4등급에 해당하는 중등증의 골관절염 환자를 대상으로 무릎관절강 내 퓨어스템-오에이 키트주를 단회투여한 후 안전성 확보와 연골재생을 포함한 구조적 개선 및 통증관리의 유효성을 탐색한다.
임상 1상에서는 최대 18명의 골관절염 환자에게 저용량, 중용량, 고용량에 대한 내약성과 안전성을 확인할 예정이다. 임상 2a상은 총 50명의 골관절염 환자에게 안전성이 확인된 두 시험약 용량군의 6개월간 유효성을 위약군과 비교하고, 장기추적조사와 연계해 12개월 시점에서의 유효성도 탐색할 계획이다.





