신종 코로나바이러스 감염증(코로나19) 백신의 국내 접종이 본격적으로 속도를 내고 있다. 아스트라제네카 백신 허가를 시작으로 다국적 제약사들이 개발한 백신을 순차적으로 접종할 예정이다. 국내 제약·바이오기업들도 백신 개발에 돌입했지만, 다국적제약사는 물론 러시아나 중국과 비교해도 아직 갈 길이 멀다.
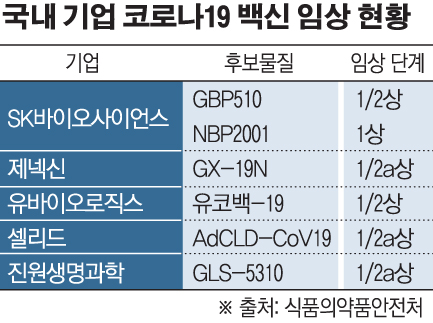
14일 식품의약품안전처에 따르면 코로나19 백신 임상에 진입한 국내 제약바이오기업은 SK바이오사이언스와 제넥신, 유바이오로직스, 셀리드, 진원생명과학 등 5개 기업 총 6종이다. 모두 1상이나 1/2상의 임상 초기 단계다.
현재 다국적제약사가 개발한 코로나19 백신은 10일 아스트라제네카의 '한국아스트라제네카코비드-19백신주'가 첫 번째로 국내 품목허가를 획득했다. 화이자의 '코미나티주'는 지난달 25일 허가심사에 들어가 2월 말~3월 초 사이에 허가될 전망이다. 식품의약품안전처는 도입이 예정된 코로나19 백신의 제조사가 허가를 신청하는 대로 신속히 처리할 계획이다. 따라서 올해 코로나19 예방 접종은 다국적제약사의 백신만으로 진행될 것이란 전망이 우세하다.
국내 기업은 대부분 내년을 내다보고 있다. 코로나19 팬데믹(대유행)이 장기화한 만큼 효능만 확실하면 개발 순서가 밀려도 시장성이 충분하다는 판단에서다. 코로나19 백신이 인플루엔자(독감) 백신과 마찬가지로 해마다 접종해야할 가능성이 있다는 점도 후발 주자들에게 긍정적인 소식이다.
SK바이오사이언스는 지난해 11월 'NBP2001'의 임상 1상 진입에 이어 빌&멜린다게이츠재단과 전염병대비혁신연합(CEPI)의 지원을 받는 'GBP510'의 임상 1/2상에 착수했다. 미국 워싱턴대학 항원 디자인연구소와 공동 개발한 BP510은 면역 효과를 최대화할 수 있는 구조의 항원으로 설계된 것이 특징으로, 차세대 코로나19 백신 프로젝트에 선정됐다.
국내 기업 중 가장 먼저 코로나19 백신 임상을 시작한 제넥신은 지난해 말 후보물질을 'GX-19N'으로 변경, 새롭게 임상을 진행하고 있다. 기존의 스파이크 항원에 높은 서열보존성을 가진 뉴클리오캡시드 항원을 추가 탑재해 코로나19 바이러스의 변종이나 추가 팬데믹 상황에도 대응할 수 있다는 것이 회사 측의 설명이다. 올해 말 허가 신청을 목표로 하고 있다.
셀리드와 진원생명과학은 지난달 환자 투약을 시작했다. 임상 1상에서 30명, 2a상에서 120명을 모집하는 셀리드는 상반기 내에 1000명을 대상으로 하는 임상 2b상에 진입하겠다는 계획이다. 진원생명과학은 임상 1상 중간평가에서 안전성을 확인, 백신의 효능을 높이기 위해 투여량을 2배로 늘렸다. 내년 상반기 사용이 목표다.
가장 최근 임상에 착수한 유바이오로직스는 올해 하반기 임상 3상 진입을 위해 박차를 가하고 있다. 임상 3상은 3000명을 모집할 예정이다.
특히 팬데믹 상황이 끝나더라도 개발 비용을 정부가 보전하는 제도를 마련하고, 나아가 책임지고 구매해 수익을 낼 수 있도록 해줘야 한다는 목소리가 나온다. 업계 관계자는 "국산 백신 개발은 백신주권 실현을 위해 반드시 필요한 과정"이라며 "기업들이 현실적인 문제에 봉착하지 않도록 정부가 적극적인 지원 방안을 제시해야 한다"고 말했다.











![직장인 설 상여금, 10명 중 4명은 받는다 [데이터클립]](https://img.etoday.co.kr/crop/320/200/2294169.jpg)