WHO 임상시험은 최종 결과 발표 후 검토 예정…미국 NIAID 임상시험에선 효과 확인
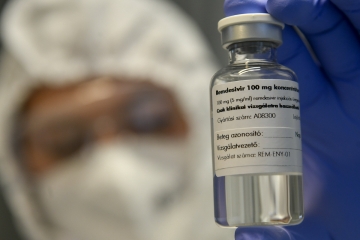
식품의약품안전처와 질병관리청이 코로나19 환자에게 ‘렘데시비르’의 투여를 지속하도록 권고했다. 렘데시비르가 코로나19 환자에 미치는 영향이 거의 없다는 세계보건기구(WHO)의 발표가 있었지만, 미국 국립알레르기 및 감염병연구소(NIAID)의 임상시험을 근거해 이같이 판단했다.
식약처와 질병청은 최근 세계보건기구(WHO)에서 발표한 ‘렘데시비르’의 임상시험 결과와 관련해 제품의 허가사항에 따라 의료진의 판단 아래 렘데시비르 투여를 지속하도록 권고했다고 23일 밝혔다.
앞서 WHO는 지난 5일 ‘렘데시비르’ 임상시험 결과 코로나19 환자에 미치는 효과가 거의 없다는 연구 결과를 발표했다. WHO가 입원 환자 1만1266명을 대상으로 진행한 ‘연대 실험’에서 렘데시비르가 환자의 입원 기간을 단축하거나, 사망률을 낮추지 못한 것이다.
식약처는 NIAID가 주도한 임상시험 결과를 의미 있게 보고, 렘데시비르를 지속해서 사용하도록 권고했다. NIAID의 임상시험 결과에 따르면 렘데시비르를 투여한 환자의 회복기간이 그렇지 않은 환자보다 5일 더 단축된 것으로 나타났다. 길리어드는 코로나19 환자 1062명을 대상으로 한 임상시험 결과에서 렘데시비르를 투여받은 환자의 회복기간이 위약을 사용한 집단보다 5일 더 빨랐다고 밝혔다. 해당 연구결과는 국제학술지 ‘뉴잉글랜드의학저널(NEJM)’에도 발표됐다.
식약처와 질병청은 WHO 임상시험과 관련해선 최종 결과가 발표되면 다시 검토할 계획이다. 추후 시험에 등록된 대상환자, 시험을 실시한 지역 의료환경 등 시험방법과 결과를 면밀히 검토하고 전문가 자문을 비롯해 해외 규제당국과 논의를 진행할 예정이다.
식약처 측은 “렘데시비르는 현재 미국, 유럽, 일본, 대만, 싱가포르 등에서 승인돼 사용 중”이라며 “코로나19 전문가위원회 및 신종감염병 중앙임상위원회는 미국 NIAID가 신뢰도가 높은 연구방법을 사용했고, 의약품 효과에 대한 과학적 근거가 있다고 판단해 렘데시비르를 코로나19의 치료제로 사용하는 것을 유지해야한다는 입장을 밝혔다”라고 말했다.
한편 미국 식품의약국(FDA)은 제약사 길리어드사이언스의 '렘데시비르'를 현지시간 22일 코로나19 치료제로 정식 승인했다. 이에 따라 렘데시비르는 미국에서 정식으로 승인을 받은 첫 번째이자 유일한 코로나19 치료제가 됐다
애초 에볼라 치료제로 개발된 정맥주사 형태의 렘데시비르는 코로나19 입원 환자를 상대로 한 임상시험에서 효과를 보이면서 주목을 받았고, FDA는 지난 5월 이 의약품에 긴급 사용 승인을 부여했다. 이후 렘데시비르는 다른 의약품들과 함께 코로나19 중증 입원환자들을 대상으로 보조 치료제로 활용돼 왔다. 도널드 트럼프 대통령이 코로나19 진단을 받았을 때도 치료제 중 하나로 렘데시비르가 사용됐다.










![[정치대학] 이재명 대안은 김부겸·김동연?…박성민 "둘 다 명분 없다"](https://img.etoday.co.kr/crop/320/200/2105457.jpg)