아리바이오 경구용 치료제 3상 순항…젬백스 2상 결과 다음 달 발표 임박

국내에서 알츠하이머병 치료 신약이 등장할지 주목된다. 알츠하이머병은 인구 고령화로 치료제 수요가 높지만 아직 효과적인 치료법이 없어 미충족 의료수요가 크다. 국내 기업들은 글로벌 임상시험 2~3상 단계로 후보물질을 개발에 속도를 내고 있다.
2일 제약바이오 업계에 따르면 조만간 아리바이오와 SK케미칼, 젬백스 등 국내 기업들이 알츠하이머병 신약 후보물질 임상시험에서 확인한 유의미한 결과를 발표할 예정이다.
아리바이오는 12월 1일(현지시간)부터 4일까지 미국 샌디에이고에서 열리는 알츠하이머병 임상연구학회(CTAD 2025)를 통해 AR1001 임상 3상 연구 ‘POLARIS-AD’ 등 4건의 초청 발표를 진행한다. 아리바이오의 AR1001 글로벌 임상 3상은 북미·유럽·아시아 등 230여 개 임상기관에서 1535명의 초기 알츠하이머병 환자 대상으로 진행 중이며, 다중기전 경구치료제 중 최대 규모다.
AR1001은 아리바이오가 2011년 SK케미칼로부터 이전받은 포스포디에스터라아제-5(PDE-5) 억제제다. 현재 경구용 알츠하이머 치료제로 개발 중이며, 아리바이오와 SK케미칼은 최근 업무협약(MOU)을 맺고 차세대 제형 개발, 글로벌 임상 협력, 상업화 이후 제조 및 수출에서 협력하기로 합의했다.
아리바이오는 AR1001에 대한 해외 기술수출에도 성공했다. 올해 6월 아랍에미리트(UAE) 아부다비에 본사를 둔 글로벌 생명과학 기업 아르세라(Arcera)와 AR1001에 대한 독점 판권 및 의약품 공급 계약을 체결했다. 계약은 총 6억 달러(약 8620억 2000만 원) 규모다. 아르세라는 중동, 중남미, 아프리카, 우크라이나 및 독립국가연합(CIS) 지역에 대한 AR1001의 독점 판매권을 확보했으며, 아리바이오는 AR1001의 글로벌 생산 및 공급을 담당한다.
젬백스는 이달 초 GV1001에 대한 글로벌 2상 결과 공개한다고 예고했다. 젬백스는 미국 및 유럽 7개국에서 진행한 알츠하이머병 2상 연구의 최종 결과 보고서(CSR)를 2주 내 수령할 예정이다. GV1001의 글로벌 2상은 2022년 10월 미국에서 첫 환자 등록을 시작으로 미국과 유럽 7개국 43개 기관에서 경증에서 중등증 단계의 알츠하이머병 환자 199명을 대상으로 진행됐다.
GV1001은 펩타이드 기반 신약후보물질로, 신경세포 내 베타아밀로이드 축적과 타우 단백질의 응집을 억제하는 기전이다. 항염증·항산화, 미토콘드리아 보호 등 다양한 효과도 동시에 나타나는 것으로 확인됐다. GV1001은 미국 식품의약국(FDA) 패스트트랙 및 희귀의약품, 유럽 의약품청(EMA) 희귀의약품 등으로 지정받은 상태다.
젬백스는 앞서 국내에서 실시한 알츠하이머병 2상 임상시험을 통해 GV1001의 치료제 가능성을 확인한 바 있다. 당시 중등도에서 중증 단계의 환자를 대상으로 6개월간 투약을 진행한 결과, 중증장애점수(SIB) 등 주요 지표에서 위약군 대비 뚜렷한 개선 효과가 나타났다. GV1001 투여와 관련된 중대한 부작용이나 이상 반응은 보고되지 않아 약물의 안전성을 확인했다.
알츠하이머병은 치매의 주요 원인으로, 한국을 비롯한 선진국의 인구 고령화에 따라 치료제 수요가 증가하고 있다. 레켐비(성분명 레카네맙)과 키순라(성분명 도나네맙) 등 뇌의 과도한 아밀로이드 베타 축적을 막는 기전의 치료제가 FDA 허가를 획득했지만, 초기 환자에게만 투약을 고려할 수 있으며 효과성과 부작용에 대한 논란도 제기되는 상황이다.
전 세계 알츠하이머병 치료제 시장 규모는 지속적인 성장세를 보이고 있다. 글로벌 시장조사기관 MARC에 따르면 2024년 전 세계 알츠하이머 치료제 시장 규모는 81억 달러(약 11조6372억 원)에 도달했으며, 5.07%의 성장률을 유지해 2033년에는 129억 달러(약 18조5334억 원)까지 성장할 것으로 전망된다.





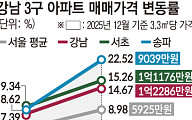



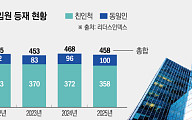

![[찐코노미] 삼성전자·SK하이닉스 웃고, 방산주 뜬다…투자 방향은](https://img.etoday.co.kr/crop/320/200/2283942.jpg)