국내 기업, 세계 최대 미국 시장 공략
소형화·정확도 강점…보험 코드·상용화 관건
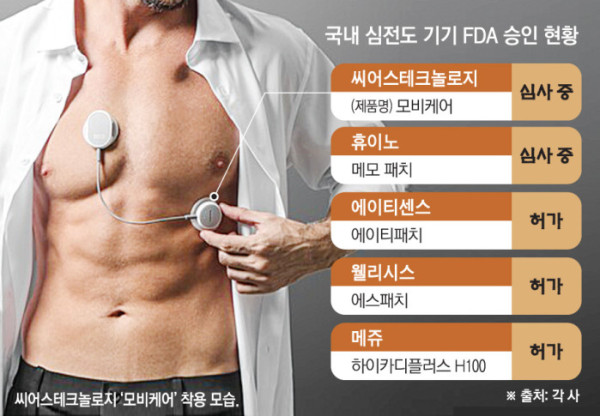
심전도 기기는 심혈관질환 진단과 관리의 핵심 도구다. 과거에는 병원에서만 측정할 수 있었지만 현재 웨어러블 패치나 스마트워치로 일상에서 모니터링이 가능해졌다. 최근 세계 최대 의료기기 시장인 미국에서 수요가 증가하면서 국내 기업들이 미국 식품의약국(FDA) 문을 두드리며 글로벌 경쟁에 뛰어들고 있다.
16일 본지 취재를 종합하면 씨어스테크놀로지·휴이노·에이티센스·웰리시스·메쥬 등 ‘K-심전도’ 대표주자들이 FDA 허가를 발판으로 글로벌 무대에 도전하고 있다. 미국은 전 세계 웨어러블 심전도 기기 점유율이 82.1%에 달하는 시장으로 빅테크와 스타트업이 치열하게 각축을 벌이는 가운데 국내 기업들도 속속 합류하는 모습이다.
씨어스테크놀로지는 인공지능(AI) 심전도 분석 솔루션 ‘모비케어(mobiCARE™)’로 FDA 심사를 진행 중이다. 국내에서는 누적 50만 건 이상의 진단 데이터를 축적하며 상용화 성과를 입증했고 상반기 매출 22억 원을 기록했다. 승인이 완료되면 미국 병원 및 연구기관과의 협력 확대가 기대된다.
휴이노는 ‘메모 패치(MEMO Patch)’를 앞세워 미국 진출에 나서고 있다. 최대 14일간 연속 심전도 측정이 가능해 간헐적으로 발생하는 부정맥을 진단할 수 있다. 올해 7월 기준 국내 누적 검사 건수는 1만 건을 돌파했다. 회사 측에 따르면 FDA 승인 절차는 차질 없이 진행 중이며 승인 이후 곧바로 미국 시장에 진출할 수 있도록 하고 있다.
에이티센스는 국내 기업 중 가장 먼저 FDA 문턱을 넘었다. 2022년 장기연속 부착형 웨어러블 심전도 패치 ‘에이티패치(AT-Patch)’에 이어 올해는 분석 소프트웨어 ‘에이티리포트(AT-Report)’까지 승인을 받으며 기기와 소프트웨어 시장을 공략할 수 있게 됐다. 특히 올해 7월에는 현지 주요 유통사와 2개 제품을 3년간 약 500억 원 규모에 달하는 공급 계약을 체결했다.
웰리시스는 현재 본격적으로 매출을 내고 있다. 이 회사는 2023년 3일 이내 단기 검사용 에스패치(S-Patch Ex)와 2024년 최대 14일간 장기 검사가 가능한 에스패치(S-Patch) ExL에 대한 FDA 허가를 받았다. S-Patch ExL은 실시간 데이터 전송 기능을 갖추고 있어 미국에서 모바일 심전도 모니터링 수가를 적용받았으며 공·사보험 커버리지를 확보해 상용화가 이뤄지고 있다.
메쥬는 지난해 심전도 모니터링 플랫폼 ‘하이카디플러스(Hicardi+) H100’와 클라우드 기반 분석 소프트웨어 ‘라이브스튜디오’로 FDA 허가를 받았다. 기존 기기들이 클라우드 서버를 거쳐야만 분석이 가능했던 것과 달리 단말기 자체에서 심전도 데이터를 실시간 분석할 수 있다는 점이 특징이다. 현재 국내 의료현장에서 활용되고 있으며 일본·사우디 등 해외 인증도 확보해 글로벌 확장을 준비하고 있다.
전문가들은 국내 기업들의 미국 진출이 단순한 기기 판매에 그치지 않고 AI 분석과 클라우드 플랫폼으로 확장될 것으로 전망한다. 한국 기업들은 소형화·정확도·가격 경쟁력에서 차별화를 꾀하고 있다. 다만 FDA 인허가, 보험 코드 확보 등 높은 진입 장벽은 여전히 숙제로 꼽힌다. 실제로 일부 기업들은 이미 허가를 받았음에도 본격적인 상업화에는 시간이 걸리고 있다.
향후 시장 전망도 긍정적이다. 시장조사기관 아이마크(IMARC)에 따르면 글로벌 심전도 기기 시장 규모는 2024년 61억 달러(약 8조 원)에서 연평균 6.93% 성장해 2033년 약 112억 달러(15조 원)에 달할 것으로 전망된다.





