SK바이오사이언스의 코로나19 백신 후보물질이 우수한 임상 1ㆍ2상 결과를 확보했다.
SK바이오사이언스는코로나19 백신 후보물질 ‘GBP510’의 임상 1ㆍ2상 분석 결과에서 긍정적인 면역반응과 안전성을 확인했다고 5일 밝혔다. GBP510은 미국 워싱턴대학 약학대 항원디자인연구소(Institute for Protein Design, IPD)와 공동으로 개발하고 글락소스미스클라인(GSK)의 면역증강제(Adjuvant) 기술을 활용한 후보물질이다.
회사에 따르면 고려대 구로병원 등 14개 기관에서 건강한 성인 328명을 대상으로 GBP510을 투여하는 임상 1ㆍ2상을 진행한 결과 면역증강제를 함께 투여한 투약군 99% 이상에서 코로나19 바이러스를 무력화하는 중화항체가 형성된 것을 확인했다.
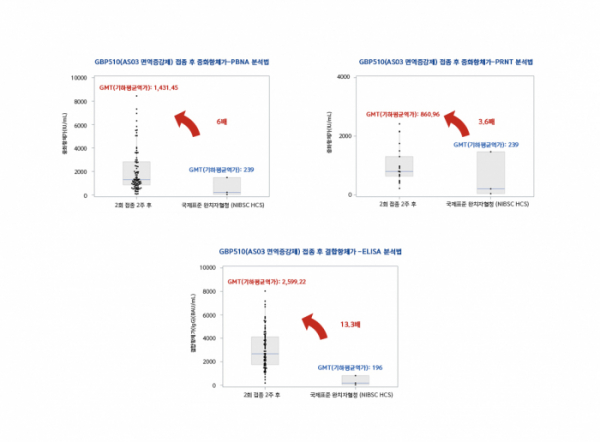
백신 접종 완료 후 2주 경과 시점의 중화항체 유도 수준은 코로나19 완치자의 혈청 패널과 비교해 전체 임상군 대상 분석의 PBNA(유사바이러스 기반 중화항체, Pseudovirion-Based Neutralization Antibody)에선 약 6배로 높게 나타났고, 일부 그룹(Subset)을 대상으로 플라스크억제시험법 분석을 진행했을 때도 약 3.6배의 높은 수준으로 나타났다. 효소결합면역흡착검사 결과도 결합 항체가가 완치자 혈청 패널 대비 약 13.3배로 높았다.
일반적으로 면역 반응이 떨어지는 65세 이상 고연령층을 포함했음에도 임상 1ㆍ2상 결과에서 높은 중화항체 유도 수준이 확인된 GBP510은 기존 코로나19 백신과 비교해 유사하거나 우수한 면역원성을 보여줬다고 회사 측은 설명했다.
안전성 측면에선 GBP510 투약과 관련성이 있는 중대한 이상반응이 한 건도 발생하지 않았다.
SK바이오사이언스는 이 같은 결과를 국내외 보건당국에 제출하고, GBP510의 개발 속도도 더욱 높일 계획이다. 현재 국제백신연구소(IVI)와 함께 유럽, 동남아 등에서 다국가 임상 3상 진행을 위한 국가별 승인 과정을 진행 중으로, 이달 내 모든 대상 국가에서 임상을 개시할 예정이다.
국내에선 지난 8월 첫 투약과 함께 시작된 임상 3상이 고려대 구로병원 등 14개 임상기관에서 순조롭게 진행되고 있다. 당초 계획보다 5배 이상 많은 약 500여 명의 한국인에 대한 투약이 완료됐다.
SK바이오사이언스는 약 4000여 명을 대상으로 한 임상3상을 통해 확보한 데이터를 바탕으로 내년 상반기 GBP510에 대한 국내 보건당국의 신속 허가를 받고 세계보건기구 사전적격성평가(WHO PQ) 인증과 해외 국가별 긴급사용허가도 획득한다는 목표다.
GBP510의 초기 개발 단계부터 함께 해온 전염병대비혁신연합(CEPI)의 리처드 해치트 CEO는 “SK바이오사이언스의 코로나19 백신 임상 1ㆍ2상 결과는 상당한 기대감을 주고 있다”며 “CEPI는 앞으로도 SK바이오사이언스, 대한민국과의 협력을 지속할 것”이라고 말했다.
안재용 SK바이오사이언스 사장은 “범정부지원위원회, 복지부, 식약처, 질병청 등 국내 보건당국과 CEPI, 게이츠재단, IVI, GSK 등 글로벌 기구 및 기업들의 긴밀한 협조가 있었기에 임상1/2상을 성공적으로 진행할 수 있었다”며 “빠르게 GBP510 개발을 완료해 팬데믹 극복과 인류의 건강권 확보에 기여할 것”이라고 말했다.











![[찐코노미] 테슬라 능가하는 엄청난 것이 온다?…머스크가 일으킬 파란은](https://img.etoday.co.kr/crop/320/200/2106712.jpg)