
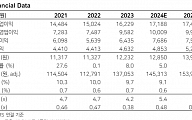
셀트리온은 미국 식품의약국(FDA)에 허쥬마(CT-P6)의 바이오의약품 품목허가를 위한 추가 보완자료를 최근 공식 제출했다고 18일 발표했다. FDA는 바이오의약품 품목허가를 위한 추가 보완서류 접수 후 통상 6개월 이내에 해당 제품의 허가 심사를 마무리한다.
셀트리온은 지난해 4월과 5월 FDA에 트룩시마와 허쥬마의 바이오의약품 품목허가를 각각 신청했다. 그러나 최근 FDA로부터 두 제품의 허가와 관련, 지난해 5월 실시된 FDA 정기실사 결과와 연관돼 CRL(Complete Response Letter)을 받았다.
셀트리온은 앞서 리툭시맙 바이오시밀러인 트룩시마와 마찬가지로 허셉틴 바이오시밀러의 미국 시장 진출 경쟁에서도 론칭 계획에 따른 순조로운 시장 진입이 가능해진 만큼, 연내 허쥬마의 허가 심사를 완료하기 위해 총력을 기울이고 있다. 트룩시마와 허쥬마의 미국 허가를 획득하면 두 제품의 미국 내 독점 판매 계약을 체결한 글로벌 대형제약사 테바(TEVA)를 통해 트룩시마와 허쥬마를 미국 시장에 조속히 선보일 계획이다.
셀트리온 관계자는 “미국의 많은 암환자들이 빠른 시일 내 적정 비용으로 효능과 안전성을 확보한 셀트리온의 항체 바이오시밀러 치료를 받을 수 있도록 허쥬마 판매 허가 및 론칭 시점을 앞당기기 위해 최선을 다하겠다”고 말했다.








!["8000원에 입장했더니 1500만 원 혜택"…프로야구 기념구 이모저모 [이슈크래커]](https://img.etoday.co.kr/crop/320/200/2017368.jpg)