상품화시 1조원 매출 기대 ... 미국 앱튜이트와 계약 체결
중외제약이 상품화 첫해 매출 1조원 이상을 기대하고 있는 혁신 신약(First in Class)인 Wnt 표적항암제가 임상 단계에 진입했다.
중외제약은 지난해 9월부터 진행하고 있는 Wnt 표적항암제 CWP231A의 전임상시험이 성공적으로 완료됨에 따라 본격적인 개발을 위해 미국 앱튜이트와 계약을 체결하고 FDA 임상에 필요한 시험용 약물 생산에 착수했다고 17일 밝혔다.
이에 따라 중외제약은 앱튜이트사의 cGMP 설비를 활용해 FDA 기준에 적합한 고품질 임상시험용 약물을 생산하고 국내외에서 개발을 본격화한다.
중외제약이 개발하고 있는 Wnt표적항암제‘CWP231A'는 암세포가 성장하는데 필수적인 특정 타겟 신호전달만을 차단해 정상세포에 대한 손상을 최소화하면서도 암세포의 증식을 억제하고 암의 전이를 막아주는 혁신적인 신약이다.
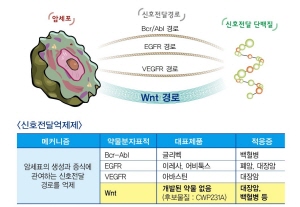
중외제약은 또 개량신약이 아닌 혁신적 신약 분야에서 리서치(Research) 단계를 넘어 개발(Development) 단계로 진입하는 것은 국내에서 처음이라고 덧붙였다
배진건 중외제약 R&D총괄전무는 “지난 2000년 이후 FDA 승인을 받은 신약은 총 234개로 이 중 First in Class 신약은 5% 수준인 15개 미만에 불과하다”며 “중외가 CWP231A 개발에 성공하면 우리나라는 미국, 영국, 프랑스, 일본 등에 이어 8번째로 혁신적 신약을 개발한 국가가 된다”고 말했다.
배전무는 또“CWP231A는 개량신약 위주의 R&D전략에 머물러 있던 국내 제약업계에서 처음으로 개발된 글로벌 기준의 혁신적 신약”이라며“이 표적항암제에 대한 다국적제약사들의 관심이 높다”고 덧붙였다.
중외제약측은 CWP231A가 상품화되면, 발매 첫해에 30조원 규모의 전세계 표적항암제 시장에서 최소 3%만 점유해도 1조원 이상의 매출을 올릴 것으로 예상하고 있다.
중외제약은 우선 당초 계획보다 적응증을 확대해 하반기부터 국내에서 급성골수성백혈병, 다발성골수종, 림포마 환자를 대상으로 임상 1상 시험에 돌입한 후, 금년 말에는 미국 FDA에 임상시험 승인(IND)을 신청한다는 전략이다.
중외제약 관계자는“당초 급성골수성백혈병을 1차 적응증으로 개발할 계획이었으나 다발성골수종과 림포마에서도 매우 우수한 데이터를 도출해 적응증을 확대하게 됐다”며 “개발기간을 단축하기 위해 다수의 다국적제약사와 공동개발, 라이선싱 아웃 등에 대한 협의를 진행하고 있다”고 설명했다.











!["인스타그램 정지됐어요"⋯'청소년 SNS 금지', 설마 한국도? [이슈크래커]](https://img.etoday.co.kr/crop/320/200/2293582.jpg)