바이오니아 자회사 써나젠테라퓨틱스가 siRNA 기반 특발성 폐섬유증 신약 SRN-001에 대한 임상 1상 마지막 4단계 안전성검토위원회를 성공적으로 완료했다고 29일 밝혔다.
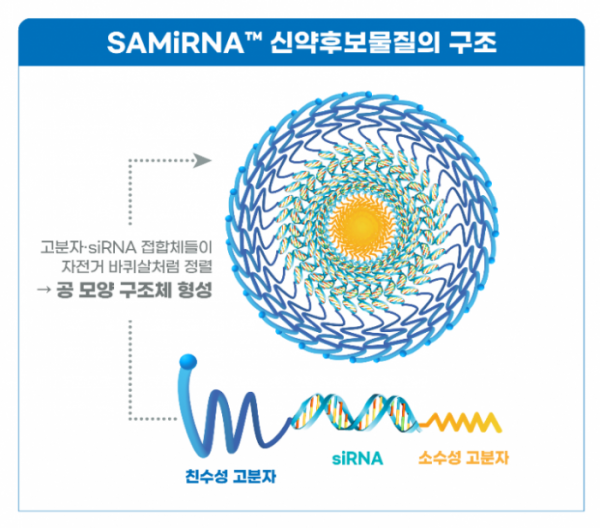
써나젠테라퓨틱스는 지난해 9월부터 체내 투여 시 쉽게 분해돼 병소까지 전달이 어렵고 선천면역 염증 반응 부작용을 일으키는 기존 siRNA 치료제의 문제점 해결이 가능한 초분자 siRNA 나노 구조체 SAMiRNA™ 기반 특발성 폐섬유증 신약 호주 임상 1a상을 진행해왔다.
회사는 1단계 저용량 약물 투여를 시작으로 투여량을 늘리며 올해 2월 4단계 고용량 약물 투여를 마쳤고 최근 이에 대한 최종 안전성검토위원회(SRC) 평가를 완료했다.
안전성검토위원회는 다양한 안전성 관련 분석결과를 통해 본 임상시험의 최고 용량에서도 SRN-001의 MTD(Maximum Tolerated Dose)에 도달하지 않았다고 결론을 내렸다. 또 임상시험수탁기관(CRO)에서 각 분석 결괏값에 대한 데이터 적합성을 확인하고 추가적인 통계 분석을 거쳐 9월 중 최종 임상시험결과보고서(CSR)를 발행할 계획이라고 밝혔다.
특발성 폐섬유증은 진단 후 5년 생존율이 40%를 밑도는 난치성 질환으로, 기존 개발된 약물은 병의 진행속도를 지연시키는 정도에 그친다. 반면 써나젠테라퓨틱스가 개발 중인 SRN-001은 섬유증 유발 mRNA를 원천적으로 분해해 병의 근원적인 해결이 가능할 것으로 기대되고 있다.
회사 관계자는 “차세대 siRNA 신약 후보 물질 SRN-0001은 물론 SAMiRNA™ 플랫폼 자체에 대해 관심을 갖고 당사의 임상 1상 진행 상황 업데이트를 원하는 글로벌 제약 기업이 많다”며 “6월 초 미국에서 개최되는 바이오 USA에서 사전 일정 조율된 기업들과 별도 미팅을 진행할 예정”이라고 전했다.





