결핵 치료제인 ‘리팜피신’을 함유한 의약품 중 니트로사민 계열 불순물(MNP)가 초과 검출됐지만 건강상 미치는 영향은 없는 것으로 나타났다. 이에 식품의약품안전처는 의료기관에 ‘리팜피신’ 함유 의약품을 계속 처방할 것을 권고했다.
식약처가 ‘리팜피신’ 함유 의약품을 수거ㆍ검사한 결과, 니트로사민 계열 불순물(MNP)이 잠정관리기준을 초과해 검출됐지만, 환자에게 미치는 건강상 영향이 크지 않았다고 21일 밝혔다.
이번 ‘리팜피신’ 함유 의약품 수거ㆍ검사는 지난해 미국에서 리팜피신(미국명: 리팜핀) 함유 의약품 중 일부에서 니트로사민 계열 불순물(MNP)이 잠정관리기준을 초과해 검출된 사실이 밝혀지면서 식약처가 국내 제품의 안전성을 확인하기 위해 지난해 9월부터 착수한 것이다.
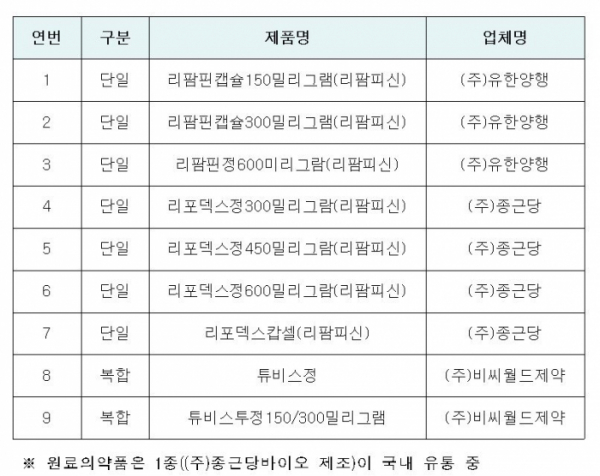
리팜피신은 결핵 1차 치료제로 사용되는 국가필수의약품으로, 현재 생산ㆍ유통되는 제품은 완제의약품 9품목(3개사), 원료의약품 1품목(1개사)이 있다. MNP는 니트로사민 계열의 화합물로, 발암가능성 평가 자료가 없어 중앙약사심의위원회 자문을 통해 이미 알려진 NDMA(NDMA(N-니트로소디메틸아민, WHO 국제 암 연구소가 지정한 인체 발암 추정물질) 평가 자료를 적용해 잠정관리기준 설정한다.
식약처의 수거ㆍ검사 결과, 국내 유통 중인 모든 ‘리팜피신’ 함유 의약품에서 MNP가 잠정관리기준(0.16ppm)을 초과해 검출됐고 완제의약품에서 MNP의 함량은 1.68ppm ~ 6.07ppm으로 나타났다. 이 검출 결과는 결핵 치료에 필수적인 의약품의 공급 부족을 방지하고 환자 접근성을 고려해 ‘유통 허용한도’를 설정한 미국의 기준(5ppm)과 유사한 수준이다.
잠정관리기준을 초과한 ‘리팜피신’ 함유 의약품이 대다수 환자에게 건강상 미치는 큰 영향은 없는 것으로 나타났다. ‘리팜피신’ 복용 환자에 대한 인체영향평가는 해당 의약품의 일일 최대 복용량(600mg)을 일반적인 복용기간(1년 이하) 동안 복용한 상황을 가정해 수행했는데 그 결과 일반적인 상황에 더해 추가적으로 암이 발생할 가능성은 ‘10만 명 중 0.29명’으로 매우 낮은 수준인 것으로 확인됐다.
식약처는 건강보험심사평가원의 처방 자료를 기반으로 실제 의약품 복용실태를 반영한 인체영향평가를 올해 실시해 복용환자의 건강에 미치는 영향을 추가로 평가할 계획이다.
식약처는 △‘리팜피신’이 생명을 위협할 수 있는 결핵 치료에 필수적인 의약품으로, 대체 의약품이 없다는 점 △인체영향평가 결과 건강에 대한 영향이 크지 않다는 점 △MNP 검출에 대해 전 세계적으로 유사하게 조치한 상황이라는 점을 고려하고, 중앙약사심의위원회의 자문 결과 등을 종합적으로 검토해 MNP 함량이 잠정관리기준(0.16 ppm)을 초과한 ‘리팜피신’ 중 2.1ppm 이하인 제품에 대한 제조ㆍ판매를 한시적으로 허용하기로 했다.
식약처는 의료기관에 기존 처방 가이드라인 등에 따라 ‘리팜피신’ 함유 의약품의 처방을 계속할 것을 권고했고, 복용환자에게는 건강에 우려가 있더라도 임의로 복용을 중단하지 말고 의약품을 처방한 의료진과 반드시 상의할 것을 당부했다.
미국 식품의약국(FDA) 등 각국 규제기관 또한 ‘리팜피신’ 함유 의약품의 사용을 중지하는 것은 MNP 섭취로 인한 잠재적인 위험성을 감수하는 것보다 환자에게 더 큰 위험을 초래해 환자의 질병 치료를 위해 의약품을 지속 복용해야 한다고 발표했다.
식약처는 ‘리팜피신’ 원료 중 MNP 함량을 잠정관리기준 이하로 낮추기 위해 관련 업계와 소통 창구를 개설하는 등 협력체계를 구축했다. 다만 원료의약품 제조 시 새로운 공정을 도입해야 하는 등 다소 시간이 걸릴 것으로 판단돼 2단계로 저감화하는 방안을 마련했다.
우선 1단계로 MNP 함량이 2.1ppm 이하인 완제의약품만을 출하하도록 할 계획이다. 제조업체에서 MNP 시험검사 결과를 제출받아 기준 이하인 경우에만 시중 유통하도록 허용했는데 이는 일반적인 복용기간(1년 이하)과 하루 최대 복용량(600mg)을 고려해 국제 가이드라인(ICH M7)에 따라 계산한 값으로 중앙약사심의위원회 자문을 거쳐 정했다. 다음으로 좀 더 높은 수준의 원료의약품 제조공정 개선이 필요한 2단계 저감화(0.16ppm) 목표도 최대한 신속하게 달성하기 위해 업계와 지속해서 논의하고 있다.





