GSK, 아스트라제네카·사노피 이어 모더나, 화이자도 참전 준비

호흡기세포융합바이러스(RSV) 백신 및 항체주사가 비급여 ‘프리미엄 백신’ 시장의 한 축으로 자리 잡을지 주목된다. 화이자, 모더나, GSK 등 글로벌 빅파마 제품들이 국내 시장에서 점유율 경쟁을 본격화했다.
18일 제약바이오 업계에 따르면 현재 국내 허가돼 사용 중인 RSV 예방용 의약품은 GSK가 개발한 백신 ‘아렉스비’와 아스트라제네카·사노피가 공동 개발한 항체 주사제 ‘베이포투스’다. 백신은 약독화한 항원을 주입해 체내에서 항체가 생성되도록 유도하는 반면 항체주사는 체내에 직접 항체를 주입해 면역 효과를 얻는다. 항체주사는 면역 효과가 즉각 나타나지만, 백신과 비교해 면역 지속 기간이 짧다.
RSV는 감기와 증상이 유사한 급성 호흡기 감염 바이러스 질환으로 습도와 기온이 떨어지는 10월부터 3월까지 유행한다. 건강한 성인은 1~2주 내 회복하지만 영유아와 노인은 합병증 위험이 크다.
아렉스비는 고령층, 베이포투스는 영유아를 대상으로 접종된다. 지난해 12월 아렉스비가 식품의약품안전처로부터 허가받은 적응증은 60세 이상 성인에서 RSV에 의한 하기도 질환(LRTD)의 예방이다. 베이포투스는 지난해 4월 식약처로부터 생후 첫 RSV 계절을 맞은 신생아와 영아, 24개월 이하 고위험군 소아 대상 적응증을 확보했다. 항체주사인 베이포투스 이외에 영유아를 대상으로 허가된 백신은 없다.
현재 아렉스비와 베이포투스는 모두 국가필수예방접종(NIP) 사업에 포함되지 않아 고가의 비급여 의약품으로 판매 중이다. 일선 의료기관들이 게시한 비급여진료비 정보에 따르면 아렉스비는 약 30만 원, 베이포투스는 40만 원에서 높게는 70만 원 수준의 비용이 책정돼 있다. 가격 부담이 크지만 다른 선택지가 없는 만큼 접종 수요가 집중되는 양상이다.
이런 가운데 모더나와 화이자도 국내 RSV 예방용 의약품 시장에 출사표를 던졌다. 모더나는 백신 ‘엠레스비아’를, 화이자는 백신 ‘아브리스보’를 각각 식약처에 허가 신청하고 심사 절차를 밟고있다.
엠레스비아는 최초의 비코로나19 메신저 리보핵산(mRNA) 기반 백신으로 미국 식품의약국(FDA)과 유럽의약품청(EMA) 등에서 60세 이상 고령층을 대상으로 허가돼 사용 중이다. 최근 FDA는 엠레스비아의 접종 대상을 18~59세 사이의 고위험군 환자까지 확대 승인했다.
아브리스보는 RSV의 두 주요 아형인 RSV-A, RSV-B에 의한 하기도질환(LRTD)을 예방하는 2가 백신이다. FDA와 EMA 등으로부터 60세 이상 고령층 접종, 신생아 보호를 목적으로 하는 임산부 접종 적응증을 승인받았다. 이후 지난해 미국, 올해 5월 유럽에서 모두 접종 대상 연령대가 18~59세까지 확대 승인됐다.
한국 공공·민간 시장 모두 글로벌 빅파마들의 격전지로 부상할 전망이다. 시장을 선점한 RSV 관련 의약품이 소수이고, 아직 NIP 사업에 진입한 제품도 없어서다. RSV 백신 후보물질 ‘EuRSV’을 임상 1상 단계에서 개발 중인 유바이오로직스를 빼면 국내 기업 중 빅파마의 견제를 받을 경쟁자도 없다.
국내 백신 시장의 급격한 성장세에 따라 기업들의 경쟁도 치열해질 것으로 예상된다. 한국보건산업진흥원에 따르면 지난해 9억4840만 달러(1조3832억 원)에서 올해 10억2480만 달러(1조4946억 원)를 기록한 뒤 매년 10%씩 성장해 2029년 14억9040만 달러(2조1737억 원)에 이를 전망이다.




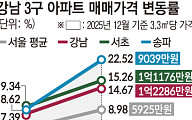


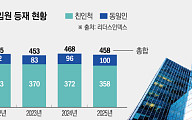



![[찐코노미] 삼성전자·SK하이닉스 웃고, 방산주 뜬다…투자 방향은](https://img.etoday.co.kr/crop/320/200/2283942.jpg)