식약처, 의약품 허가규정 개정…1327개 제약·수입업체 대상

▲(사진=식품의약약안전처 제공)
26일 제약업계에 따르면 식품의약품안전처는제약사가 의약품의 품목허가·신고·심사 시 원료의약품 제조공정에 사용되는 시약, 출발물질, 중간생성물질 등의 안전성 입증자료를 제출하도록 하는 내용의 ‘의약품 품목허가·신고·심사규정 일부 개정안’을 행정 예고했다.
이는 고혈압 원료의약품 ‘발사르탄’에서 발암 가능 물질이 검출된 데 따른 후속 조치다. 식약처는 발사르탄에서 발암물질인 ‘N-니트로소디메틸아민’(NDMA)이 검출돼 200개 넘는 의약품이 회수되는 등 국민 불안이 가중되자 의약품 심사자료 요건을 강화했다고 설명했다.
유전독성이나 발암물질의 경우 발암확률 10만분의 1 수준 이하로 관리된다는 사실도 입증해야 한다. 개정된 식약처 규정이 시행되면 의약품 제조사 634개와 의약품 수입업체 693개가 안전성 입증자료 제출을 위해 약 91억1700만원을 투자해야 할 것으로 추정된다.
이번 개정안은 의견 수렴을 거쳐 고시될 예정이다. 개정안에 대해 의견이 있으면 11월 19일까지 식약처에 제출하면 된다. 전체 개정안은 고시 후 시행될 에정이지만 의약품에 대한 제약사의 안전성 입증해야 의무가 담긴 규정은 고시 후 1년이 경과한 날부터 시행된다.





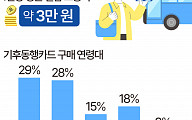
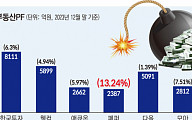



![올림픽 목표 금메달 10개→7개 →5개…뚝뚝 떨어지는 이유는 [이슈크래커]](https://img.etoday.co.kr/crop/320/200/2014368.jpg)