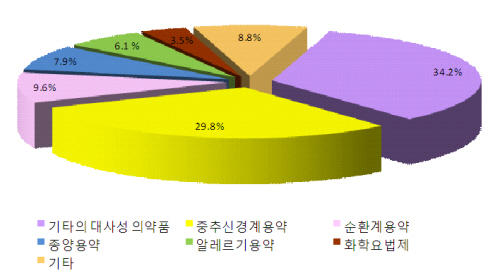
식품의약품안전청은 2011년 제네릭의약품 상반기 개발동향 분석한 결과, 당뇨병치료제인 글리메피리드·메트포르민염산염 복합제와 여성 골다공증치료제인 이반드론산나트륨 등이 포함된 기타의 대사성 의약품이 34%를 차지했다고 14일 밝혔다.
신경병증성 통증치료제인 프레가발린이 포함된 중추신경계용 의약품은 30%를 차지해 그 뒤를 따랐다. 성분별 제네릭 개발 상황을 살펴보면, △신경병증성 통증치료제 프레가발린(20건) △당뇨병 치료제 글리메피리드·메트포르민염산염 복합제(16건) △골다공증 치료제 이반드론산나트륨(10건) 등이 40%를 차지했다.
제네릭 개발을 위한 생동성시험 승인 건수는 114건으로 전년 상반기(176건)에 비해 35% 감소했다. 이는 지난해에 이미 생산규모가 큰 당뇨병 치료제 아마릴엠정(글리메피리드·메트포르민염산염)등에 대한 생동성 시험계획서가 이미 57건이나 승인 받았기 때문이다.
한편 식약청은 생동성 시험이 진행될 시 △생동성시험 실시당일 시험기관 직접 방문 △담당의사의 생동성시험 참여 피험자에 대한 충분한 설명 △피험자 동의여부 △피험자에 대한 보상규약 준수여부 △약물 유해반응에 대한 대책 마련여부 △피험자가 3개월내 다른 생동성 시험등 참여여부 △자료 조작 방지 프로그램(Audit trail)을 설치여부 등 피험자 보호와 시험결과 신뢰성 담보여부를 집중적으로 점검했다고 밝혔다.











![키키도 소환한 그 감성⋯Y2K, 왜 아직도 먹히냐면요 [솔드아웃]](https://img.etoday.co.kr/crop/320/200/2292619.jpg)