‘코로나19’ 개별 환자 대상 치료목적으로 식약처 사용 승인

이에 앞서 식약처는 서울대병원이 요청한 이뮨메드의 VSF를 코로나19의 치료 목적으로 사용하는 것을 지난달 21일 승인했다. 첫 투약일 기준 총 4회(1/3/7/14일차)의 투약을 계획하고 있으며, 투약 후 서울대병원과 식약처 및 이뮨메드 관계자들이 약물 효과와 부작용에 대한 합동 모니터링을 진행하고 있다.
식약처가 사용 승인한 이뮨메드의 치료제는 'HzVSFv13주'다. 이는 이뮨메드가 개발하는 신약 후보 임상시험용 의약품인 VSF의 주사제로, 2018년부터 건강한 남성을 시험 대상자로 정맥투여 후 안전성과 내약성, 약동학적 특성을 평가한 임상 1상을 서울대학교 병원에서 진행했다. 현재는 마무리 단계로 오는 4월 임상 1상에 대한 최종 결과 보고서가 나올 예정이다.
또한 이뮨메드는 현재 개별 환자 대상으로만 투약 가능한 것과 별개로 최대 25인까지 투약 가능한 ‘제공자(이뮨메드) 주도의 치료 목적 사용 승인’을 지난달 4일 신청해 식약처의 승인을 기다리고 있다.
김윤원 이뮨메드 대표는 “'HzVSFv13주'는 식약처의 승인을 받아 코로나19 폐렴 치료를 위해 실제 환자에게 투약이 진행된 첫 번째 의약품으로, 아직 코로나19의 확실한 치료제가 없는 상황에서 중등증 이상 폐렴 환자들의 치료에 도움이 될 것”이라며, “환자가 많은 종합병원들의 협조를 통해 중등증 이상의 코로나19 폐렴 환자에게 조속히 VSF를 무료로 투약함으로써 치료 기간을 단축하고 사망률이 급감하기를 기대한다”고 말했다.
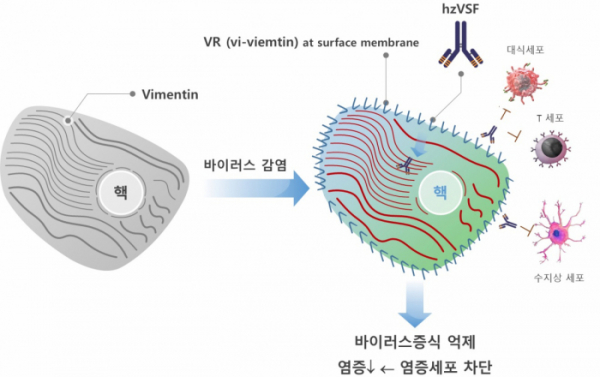
이뮨메드는 코로나바이러스 감염증을 포함해 향후 VSF를 △만성 B형간염 △인플루엔자 △일부 난치성 피부질환 등 다양한 바이러스 질환의 치료제로 개발한다는 계획이다. 특히 만성 B형간염은 지난해 동물실험(우드척) 결과 투약 3개월 만에 50%가 완치돼 글로벌 제약사들의 주목을 받고 있다. 회사는 만성 B형간염을 적응증으로 한 임상 2상 시험 신청을 앞두고 있으며, 글로벌 임상으로 호주에서는 백인 남녀 대상의 임상 1상 투약이 곧 진행될 예정이다.











!["인스타그램 정지됐어요"⋯'청소년 SNS 금지', 설마 한국도? [이슈크래커]](https://img.etoday.co.kr/crop/320/200/2293582.jpg)