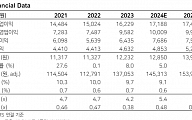
에이치엘비생명과학은 4일 관계회사 LSK Biopharma(이하 LSKB)에서 개발 중인 표적항암제 ‘리보세라닙’의 글로벌 임상3상 시험 결과가 ‘유럽종양학회’(ESMO 2019)의 콘퍼런스 제안 백서 세션(Proffered paper session)에서 구연발표(Oral Presentation) 연제로 채택됐다고 4일 밝혔다.
리보세라닙의 임상시험 결과가 구연 발표되는 콘퍼런스 제안 백서 세션은 임상시험을 직접 진행한 연구자가 발표자로서 해당 연구 과제의 핵심 쟁점 사항을 소개하고 청중과 질의 응답을 진행한다.
보통 학술 가치가 높은 주제들이 선정된다.
에이치엘비 관계자는 “리보세라닙 글로벌 임상3상 시험 결과의 가치를 ‘유럽종양학회’ 측에서 높게 평가한 것”이라며 “이번 ‘유럽종양학회’에서는 중국에서 진행된 리보세라닙(중국명 Apatinib) 관련 11개의 연구 결과 또한 발표된다”고 말했다.
△위암(GC) △비소세포폐암(NSCLC) △비인두암(Nasopharyngeal carcinoma) △육종(Sarcoma) 등 다수의 고형암을 대상으로 리보세라닙 단독요법 및 다양한 제제와의 병용요법을 실시한 결과 소개가 예정됐으며 9월 7일 세계폐암콘퍼런스(WCLC 2019)에서 발표될 6개의 임상시험 결과를 담고 있다.
한편 ‘유럽종양학회’는 미국임상종양학회(ASCO)와 함께 암 연구 분야에서 가장 권위 있는 학술대회로 꼽히며, 9월 27일부터 10월 1일까지 스페인 바르셀로나에서 개최된다.
다양한 연구 결과가 소개되는 ‘유럽종양학회’에는 전 세계 2만여 명의 암 연구자와 종양내과 전문의, 제약 바이오 기업 관계자가 참석하게 된다.
한편 LSKB는 10월 중순을 목표로 미국 식품의약처(FDA)와의 사전미팅(Pre-NDA)을 신청하는 등, 시판허가신청(NDA)까지의 일정을 가속화하고 있다.
회사 관계자는 “사전미팅(Pre-NDA)을 통해 위암 치료제로서의 리보세라닙 허가 전략을 구체화하고 있다”며 “추가 적응증 확보를 위한 다양한 임상시험 역시 박차를 가하고 있다”고 설명했다.








![[컬처콕] "뉴진스 아류" 저격 받은 아일릿, 낯 뜨거운 실력에도 차트 뚫은 이유](https://img.etoday.co.kr/crop/320/200/2017630.jpg)