엔지켐생명과학은 미국 식품의약국(FDA) 허가 하에 진행 중인 구강점막염 치료제의 임상 2a상을 완료했다고 23일 밝혔다. 이에 DSMB(안전성평가위원회)를 개최하고, 임상 2b상으로 진입한다는 계획이다.
이번 임상 2a상은 항암화학방사선 치료 환자에게 사용했을 때 약의 안전성과 최적화된 용량을 분석하기 위한 단계였다. 혁신신약물질인 EC-18을 사용해 미국 전역 17개 사이트에서 임상시험을 진행했다.
기존 항암화학방사선 치료 중 발생하는 중증 구강점막염의 평균적인 지속시간은 19~25일로 알려졌다. 24명의 환자를 네 그룹으로 나눠 각기 위약 및 용량을 달리한 투약을 통해 평균 지속시간이 크게 감소한 것이 관찰됐다.
회사 관계자는 “이중맹검 실험으로 환자 구분은 불가능하지만, 평균 지속시간의 감소가 EC-18의 효능을 확인한 결과로 볼 수 있다”며 “대개의 경우 중증 구강점막염 환자는 섭식 및 투약이 어렵지만, 이번 임상 2a상에서는 대상자의 약 60% 가량이 지속적으로 복약을 완료했다는 점에서 중증 구강점막염이 발생하지 않았음을 추정할 수 있어 효능을 확인한 결과로 해석할 수 있다”고 설명했다.
엔지켐생명과학은 오는 6월부터 임상 2b상를 통해 약물 효과성을 검증할 계획이다. 1단계를 함께 진행한 17개 사이트에 8개의 임상 사이트가 추가로 2단계에 참여한다.
이어 호중구감소증 치료제 임상 2상도 순조롭게 진행하고 있다고 밝혔다. 최근 임상 2a에서 2000mg까지 EC-18의 투약을 마쳤고, 약물 효과성 검증을 목표로 임상 2b상을 준비하고 있다.
손기영 엔지켐생명과학 회장은 “글로벌 혁신신약개발 물질인 EC-18을 활용한 구강점막염과 호중구감소증 치료제 임상 2상이 계획대로 순조롭게 진행되고 있다”며 “글로벌 라이센스에 대한 논의도 활발하게 진행하고 있다”고 말했다.


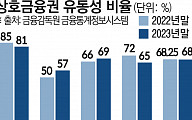





![[찐코노미] 반도체 HBM 주도로 다시 넘어온다…2차전지 원픽은 '이것'](https://img.etoday.co.kr/crop/320/200/2019784.jpg)