경구용 제형의 임상 진입 FDA 승인…하반기 임상 예정
지트리비앤티는 미국 100% 자회사 오블라토를 통해 개발 중인 뇌종양 교모세포종 치료제 신약(이하 OKN-007)의 환자 대상 임상 시험이 5월 미국식품의약국(FDA) 미팅을 통해 승인됐다.
7일 지트리비앤티에 따르면 올해 하반기에 임상 시험을 시작할 계획이며, 기존 주사제(IV) 형태에서 경구용으로 제형을 변경할 예정이다.
경구용으로 제형을 변경할 경우, 약물의 효과 지속성이 주사제에 비해 월등하며, 사용자 편의성이 크게 증가된다. 또 기존 뇌종양 표준요법 치료제와 병용 처방에 있어서도 적용이 쉽다는 장점도 있다.
FDA는 이번 미팅에서 지트리비앤티가 제안한 비임상 준비상태 및 제조 및 품질관리 계획(CMC)에 대해서도 인정한 것으로 알려졌다. 신규 임상시험은 미국 오클라호마 대학 스티븐슨암센터 등에서 재발 환자를 대상으로 진행할 예정이다.
지트리비앤티는 지난 4월, 기존 뇌종양 치료제인 테모달(미국 MSD)과 병용투여요법으로 제출한 임상시험계획(IND)을 FDA로부터 승인 받아 개발을 추진 중이다. 올해 해당 치료제로만 2건의 임상을 진행하며 개발에 박차를 가하고 있다.
최근 미국 도널드 트럼프 대통령이 서명한 일명 ‘Right to try(시도할 권리)’ 법안이 발효되면서, 말기 환자 및 희귀질환 환자를 대상으로 한 치료제 개발이 관심을 모으고 있다.
‘Right to try’ 법안은 생명을 위협받는 상황에 처한 사람들이 임상 시험을 거치지 않고도 실험치료를 받을 수 있도록 하기 위해 발효됐다.
법안에서 허용된 치료제는 △임상 1상 성공적 완료 △FDA 승인한 임상시험 지속 진행 △연방 식품·의약품·화장품법 및 공중보건법 등에 따라 승인, 허가 또는 판매허가를 받지 않은 치료제 등의 조건을 충족해야 한다. 그 대상은 생명을 위협하는 질병 또는 상태인 환자, 기존 승인된 치료 옵션을 전부 사용했고 임상시험에도 참가할 수 없는 환자, 담당 의사에게 해당 의약품에 대한 서면 동의서를 제공한 환자 등이다.
이 법안 통과로 희귀질환인 악성 뇌종양 교모세포종 치료제와 수포성표피박리증을 개발하는 지트리비앤티의 수혜가 전망된다.
지트리비앤티 관계자는 "1조 원 이상의 시장규모를 형성 하고 있는 뇌종양암(교모세포종) 신약 치료제인 'OKN-007'을 병용요법과 단일요법 두 가지 방향으로 임상 진입할 예정이다"라며 "임상 2상 완료 후 FDA에 조건부 승인 신청을 목표로 개발을 추진 중에 있다"고 말했다.




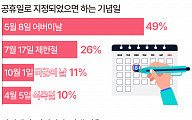




!["어버이날 쉬게 해주세요" [데이터클립]](https://img.etoday.co.kr/crop/320/200/2021654.jpg)